
【题目】合成氨工业对国民经济和社会发展具有重要的意义。对于密闭容器中的反应:
N2(g)+3H2(g)![]() 2NH3(g) △H <O,673 K,30 MPa下n(NH3)和n(H2)随时间变化的关系如下图所示。下列叙述正确的是
2NH3(g) △H <O,673 K,30 MPa下n(NH3)和n(H2)随时间变化的关系如下图所示。下列叙述正确的是
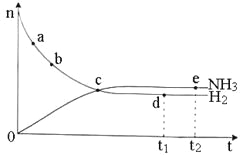
A.点b的正反应速率比点a的大B.点c处反应达到平衡
C.点d(t1时刻)和点e(t2时刻)处n(N2)不一样D.其他条件不变,773 K下反应至t1时刻,n(H2)比上图中d点的值大
科目:高中化学 来源: 题型:
【题目】LiCoO2(钴酸锂)是锂离子电池的正极材料。以某海水为原料制备钴酸锂的一种流程如下:
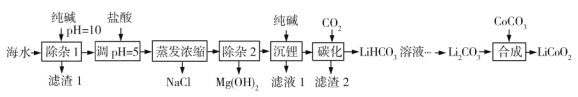
已知如下信息:
①该海水中含浓度较大的LiCl,含少量MgCl2、CaCl2、MnCl2等。
②碳酸锂的溶解度与温度关系如图所示:

③常温下,几种难溶物质的溶度积数据如下:
物质 | Li2CO3 | MgCO3 | CaCO3 | MnCO3 | Mg(OH)2 |
Ksp | 2.5×102 | 6.8×106 | 2.8×109 | 2.3×1011 | 6.0×1010 |
请回答下列问题:
(1)LiCoO2中钴的化合价为________。滤渣1主要成分有MgCO3、Mg(OH)2、CaCO3和__________(填化学式)。
(2)调节pH=5的目的是__________。
(3)“沉锂”包括过滤、洗涤等,宜用_________(填“热水”或“冷水”)洗涤Li2CO3。加入纯碱的量与锂回收率的关系如表所示:
序号 |
| 沉淀质量/g | 碳酸锂含量/% | 锂回收率/% |
① | 0.9∶1 | 10.09 | 92.36 | 77.67 |
② | 1.0∶1 | 10.97 | 90.19 | 82.46 |
③ | 1.1∶1 | 11.45 | 89.37 | 85.27 |
④ | 1.2∶1 | 12.14 | 84.82 | 85.45 |
从生产成本考虑,宜选择_______(填序号)方案投料。
(4)“除杂2”中调pH=13时c(Mg2+)=_________mol·L-1。
(5)“合成”中采用高温条件,放出一种能使澄清石灰水变浑浊的气体。写出“合成”发生反应的化学方程式________。
(6)在“合成”中制备1 mol LiCoO2转移电子的物质的量为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以二氧化碳和氢气为原料制取乙醇的反应为2CO2(g)+6H2(g)![]() CH3CH2OH(g)+3H2O(g) ΔH<0。某压强下的密闭容器中,按CO2和H2的物质的量比为1:3投料,不同温度下平衡体系中各物质的物质的量百分数(y%)随温度变化如图所示。下列说法正确的是
CH3CH2OH(g)+3H2O(g) ΔH<0。某压强下的密闭容器中,按CO2和H2的物质的量比为1:3投料,不同温度下平衡体系中各物质的物质的量百分数(y%)随温度变化如图所示。下列说法正确的是
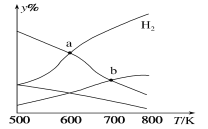
A.a点的平衡常数小于b点
B.b点,v正(CO2)=v逆(H2O)
C.a点,H2和H2O物质的量相等
D.其他条件恒定,充入更多H2,v(CO2)不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在①、②、③容积不等的恒容密闭容器中,均充入0.1molCO和0.2molH2,在催化剂的作用下发生反应:CO(g)+2H2(g)![]() CH3OH(g)。测得三个容器中平衡混合物中CH3OH的体积分数随温度的变化如图所示。下列说法正确的是
CH3OH(g)。测得三个容器中平衡混合物中CH3OH的体积分数随温度的变化如图所示。下列说法正确的是
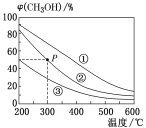
A.该反应的正反应为吸热反应
B.三个容器的容积:①>②>③
C.在P点,CO的转化率为75%
D.在P点,向容器②中再充入CO、H2及CH3OH各0.025mol,此时υ正(CO)<υ逆(CO)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化硼(BN)是一种重要的功能陶瓷材料。以天然硼砂为起始物,经过一系列反应可以得到BF3和BN,如下图所示:
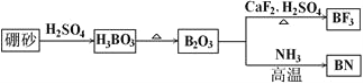
请回答下列问题:
(1)由B2O3制备BF3、BN的化学方程式依次是________________________、________________________;
(2)基态B原子的电子排布式为________;B和N相比,电负性较大的是________,BN中B元素的化合价为________;
(3)在BF3分子中,F—B—F的键角是________,B原子的杂化轨道类型为________,BF3和过量NaF作用可生成NaBF4, 的立体构型为________;
(4)在与石墨结构相似的六方氮化硼晶体中,层内B原子与N原子之间的化学键为__________,层间作用力为________________________;
(5)六方氮化硼在高温高压下,可以转化为立方氮化硼,其结构与金刚石相似,硬度与金刚石相当,晶胞边长为361.5pm。立方氮化硼晶胞中含有________个氮原子、________个硼原子,立方氮化硼的密度是________g·cm-3 (只要求列算式,不必计算出数值,阿伏加德罗常数为NA)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W是原子序数依次增大的短周期元素,且X、Z原子序数之和是Y、W原子序数之和的1/2。甲、乙、丙、丁是由这些元素组成的二元化合物,M是某种元索对应的单质,乙和丁的组成元素相同,且乙是一种“绿色氧化剂”,化合物N是具有漂白性的气体(常温下)。上述物质间的转化关系如图所示(部分反应物和生成物省略)。下列说法正确的是

A. 原于半径:r(Y)>r(Z)>r(W)
B. 化合物N、乙烯使溴水褪色的原理相同
C. 含W元素的盐溶液可能显酸性、中性或碱性
D. Z与X、Y、W形成的化合物中,各元素均满足8电子结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实,不能用勒夏特列原理解释的是( )
A.溴水中有下列平衡Br2+H2O![]() HBr+HBrO,当加入AgNO3溶液后,溶液颜色变浅
HBr+HBrO,当加入AgNO3溶液后,溶液颜色变浅
B.对2HI(g)![]() H2(g)+I2(g),平衡体系增大压强可使颜色变深
H2(g)+I2(g),平衡体系增大压强可使颜色变深
C.反应CO+NO2![]() CO2+NO(正反应为放热反应),升高温度可使平衡向逆反应方向移动
CO2+NO(正反应为放热反应),升高温度可使平衡向逆反应方向移动
D.合成NH3反应为放热反应,为提高NH3的产率,理论上应采取低温的措施
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家研究出一种以天然气为燃料的“燃烧前捕获系统”,其简单流程如图所示(条件及物质未标出)。
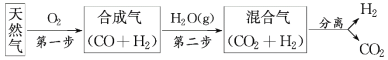
(1)已知:CH4、CO、H2的燃烧热分别为890.3 kJ·mol-1、283.0 kJ·mol-1、285.8 kJ·mol-1,则上述流程中第一步反应2CH4(g)+O2(g)===2CO(g)+4H2(g)的ΔH=____________。
(2)\在300 ℃、8 MPa下,将CO2和H2按物质的量之比1∶3 通入一密闭容器中发生反应CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),,达到平衡时,测得CO2的平衡转化率为50%,则该反应条件下的平衡常数表达式为K=________
CH3OH(g)+H2O(g),,达到平衡时,测得CO2的平衡转化率为50%,则该反应条件下的平衡常数表达式为K=________
(3)CO2经催化加氢可合成低碳烯烃:2CO2(g)+6H2(g)![]() C2H4(g)+4H2O(g) ΔH。在0.1 MPa时,按n(CO2)∶n(H2)=1∶3投料,如图所示为不同温度(T)下,平衡时四种气态物质的物质的量(n)关系。
C2H4(g)+4H2O(g) ΔH。在0.1 MPa时,按n(CO2)∶n(H2)=1∶3投料,如图所示为不同温度(T)下,平衡时四种气态物质的物质的量(n)关系。
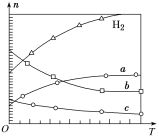
①该反应的ΔH________0(填“>”或“<”)。
②曲线c表示的物质为________。
③为提高H2的平衡转化率,除改变温度外,还可采取的措施是_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
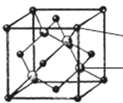
【题目】(1)Fe元素在元素周期表中位于______区,基态Fe2+的离子结构示意图为_____________。
(2)氧化亚铁晶体的晶胞如下图所示。已知:氧化亚铁晶体的密度为ρg·cm-3(NA代表阿伏加德罗常数的值)。在该晶胞中,与Fe2+紧邻且等距离的Fe2+数目为_________;Fe2+与O2-的最短核间距为_____________cm。
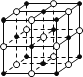
(3)金属晶体Ti采取面心立方最密堆积,则Ti原子的空间利用率是 : ________π×100%(要求写出带根号的最简计算式)。
(4)SiC晶体的硬度为9.5,其晶胞结构如下图所示(小球代表C原子,大球代表Si原子);则该晶体类型为_________,在SiC晶体中,每个Si原子周围最近的C原子数目为________个;若晶胞的边长为a pm(NA代表阿伏加德罗常数的值),则该晶体的密度表达式为_______________g/cm3(化为最简形式 )。冰晶胞中水分子的空间排列方式与上述晶胞_______(填“相似”或“不相似”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com