
【题目】常温时,下列溶液的pH或微粒的物质的量浓度关系错误的是
A. 某溶液中由水电离出的c(H+)=1×10-amol·L-1,若a>7时,该溶液pH一定为14-a
B. 0.1mol·L-1的KHA溶液,其pH=10,c(K+)>c(HA-)>c(OH-)>c(A2-)
C. 将0.2mol·L-1的某一元酸HA溶液和0.1mol·L-1NaOH溶液等体积混合后溶液pH大于7,则反应后的混合液:c(HA)>c(Na+)>c(A-)
D. 等体积、等物质的量浓度的Na2CO3溶液与 NaHCO3溶液混合:2c(Na+)=3c(CO32-)+3c( HCO3-)+3c(H2CO3)
【答案】A
【解析】
A. 常温时,某溶液中由水电离出的c(H+)=1×10-amol·L-1,若a>7时,说明水的电离受到抑制,可能为酸溶液,也可能为碱溶液,如为酸溶液,则pH=a,如为碱溶液,则pH=14-a。故A错误;
B. 0.1mol·L-1的KHA溶液,其pH=10,说明水解程度大于电离程度,溶液呈碱性,所以离子浓度大小为:c(K+)>c(HA-)>c(OH-)>c(A2-),故B正确;
C. 将0.2mol·L-1的某一元酸HA溶液和0.1mol·L-1NaOH溶液等体积混合后,得到等浓度的HA和NaA,溶液pH大于7,溶液显碱性,则说明水解大于电离,所以反应后的混合液中c(HA)>c(Na+)>c(A-),故C正确;
D.等体积、等物质的量浓度的Na2CO3溶液与 NaHCO3溶液中n(Na2CO3)=n(NaHCO3),假设各为1mol,则有2n(Na+)=3(Na2CO3)![]() 3n(NaHCO3),根据物料守恒,应有:2c(Na+)=3c(CO32-)+3c( HCO3-)+3c(H2CO3),故D正确;
3n(NaHCO3),根据物料守恒,应有:2c(Na+)=3c(CO32-)+3c( HCO3-)+3c(H2CO3),故D正确;
本题答案为A。


科目:高中化学 来源: 题型:
【题目】实验中需配制1.0 mol/L的NaOH溶液950 mL,假如其他操作均是准确无误,以下情况会引起配制溶液浓度偏高的是
A.称取40.0gNaOH固体
B.容量瓶水洗后未烘干直接使用
C.定容时俯视
D.摇匀后发现液面低于刻度线,继续加水至液面与刻度线平齐
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】燃煤废气中的氮氧化物(NOx)、CO2、SO2等气体,常用下列方法处理,以实现节能减排、废物利用等。
已知:25 ℃时,Kb(NH3·H2O)=1.8×10-5;H2SO3:Ka1=1.5×10-2,Ka2=1.0×10-7
(1)处理烟气中的SO2常用液吸法。室温条件下,将烟气通入浓氨水中得到(NH4)2SO3溶液,0.1mol/L(NH4)2SO3溶液的pH____(填“>”“<”或“=”)7。将烟气通入 (NH4)2SO3溶液可以继续吸收SO2 ,用离子方程式表示出能吸收二氧化硫的原因_________。
(2)用活性炭可以还原处理氮氧化物,有关反应为C(s)+2NO(g) ![]() N2(g)+CO2(g)。在恒容条件下,能判断该反应一定达到化学平衡状态的依据是 _______(填选项编号)。
N2(g)+CO2(g)。在恒容条件下,能判断该反应一定达到化学平衡状态的依据是 _______(填选项编号)。
A.单位时间内生成2n mol NO(g)的同时消耗n mol CO2(g)
B.混合气体的密度不再发生改变
C.反应体系的压强不再发生改变
D.混合气体的平均相对分子质量不再改变
(3)有科学家经过研究发现,用CO2和H2在210~290℃,催化剂条件下可转化生成甲醇蒸汽和水蒸气。
①230℃,向容器中投入0.5molCO2和1.5molH2,当转化率达80%时放出热量19.6kJ能量,写出该反应的热化学方程式_______________________________________。
②一定条件下,往2L恒容密闭容器中充入1.0molCO2和3.0molH2,在不同催化剂作用下,相同时间内CO2的转化率随温度变化如图1所示:
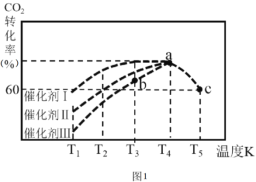
催化剂效果最佳的是催化剂 ______ (填“I”,“Ⅱ”,“Ⅲ”)。b点v(正)___v(逆) (填“>” ,“< ”,“=”)。此反应在a点时已达平衡状态,a点的转化率比c点高的原因是_______。已知容器内的起始压强为100kPa,则图中c点对应温度下反应的平衡常数Kp=________。(保留两位有效数字) (Kp为以分压表示的平衡常数,分压=总压×物质的量分数)。
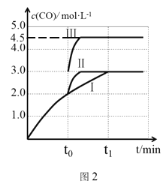
(4)一定条件下,CO2和H2也可以发生反应CO2(g)+H2(g) ![]() CO(g)+H2O(g) ΔH<0,一定温度下,在3 L容积可变的密闭容器中,已知c(CO)与反应时间t变化曲线Ⅰ如图2所示,若在t0时刻分别改变一个条件,曲线Ⅰ变为曲线Ⅱ或曲线Ⅲ。当曲线Ⅰ变为曲线Ⅱ时,改变的条件是____。当曲线Ⅰ变为曲线Ⅲ时,改变的条件是________。
CO(g)+H2O(g) ΔH<0,一定温度下,在3 L容积可变的密闭容器中,已知c(CO)与反应时间t变化曲线Ⅰ如图2所示,若在t0时刻分别改变一个条件,曲线Ⅰ变为曲线Ⅱ或曲线Ⅲ。当曲线Ⅰ变为曲线Ⅱ时,改变的条件是____。当曲线Ⅰ变为曲线Ⅲ时,改变的条件是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值。下列说法正确的是
A. 常温下,2.7g铝片投入足量的浓硫酸中,铝失去的电子数为0.3NA
B. 4.0g由H218O与D2O组成的混合物中所含中子数为2NA
C. 标准状况下,11.2LHF含有0.5NA个HF分子
D. 电解精炼铜时转移了NA个电子,阳极溶解32g铜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸橙花酯是一种食用香料,其结构简式如图所示,关于该有机物的下列叙述中错误的是
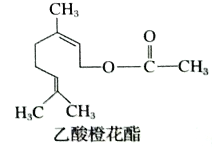
A. 分子式为C12H22O2
B. 能使酸性KMnO4溶液褪色,能发生加成反应和取代反应
C. 1mol该有机物水解时只能消耗1 mol NaOH
D. 1mol该有机物在一定条件下和H2反应,共消耗H2为2mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过以下反应可获得新型能源二甲醚(CH3OCH3)。下列说法不正确的是
①C(s) + H2O(g)==CO(g)+H2(g) ΔH1=a kJmol-1
②CO(g) + H2O(g)==CO2(g)+H2(g) ΔH2=b kJmol-1
③CO2(g)+3H2(g)==CH3OH(g)+H2O(g) ΔH3 =c kJmol-1
④2CH3OH(g) ==CH3OCH3(g)+H2O(g) ΔH4=d kJmol-1
A. 反应①②为反应③提供原料气
B. 反应③也是CO2资源化利用的方法之一
C. 反应CH3OH(g)== ![]() CH3OCH3(g)+
CH3OCH3(g)+ ![]() H2O(1)的ΔH =
H2O(1)的ΔH =![]() kJmol-1
kJmol-1
D. 反应 2CO(g)+4H2(g) ==CH3OCH3(g)+H2O(g)的ΔH= (2b+2c+d) kJmol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向铁和氧化铁的混合物中加入500mL0.20mol·L-1稀盐酸后恰好完全溶解,得到只含一种金属离子的浅绿色溶液,并收集到448mL氢气(标准状况下测定)。回答下列问题;
(1)反应后溶液中的溶质为__________mol。
(2)原混合物中单质铁的质量为___________g,氧化铁的质量为___________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在一个充满CO2的铝制易拉罐中加入适量的NaOH溶液,并密封,易拉罐会慢慢变瘪,原因是____________(用化学方程式表示,下同)后又慢慢鼓起来,原因是________________。
(2)写出还原铁粉与水蒸气反应的化学方程式_____________________。
(3)实验室用碳酸钙与盐酸反应制取CO2气体,反应的离子方程式:___________;常用澄清石灰水检验CO2气体的离子方程式是__________________________________。将表面附有铁锈(成分是Fe2O3)的铁钉放入稀硫酸中,开始反应的离子方程式是________________________________;反应片刻后,可观察到有气体产生,其离子方程式是________________________。
(4)人体胃液中有胃酸(0.2%~0.4%的盐酸),起杀菌、帮助消化等作用,但胃酸的量不能过多或过少,它必须控制在一定范围内,当胃酸过多时,医生通常用“小苏打片”或“胃舒平”给病人治疗。
①用小苏打片(NaHCO3)治疗胃酸过多的离子方程式为___________________________________________。
②如果病人同时患有胃溃疡,此时最好服用胃舒平[主要成分是Al(OH)3],反应的离子方程式为________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列装置进行相关实验,操作正确且能达到实验目的的是

A. 甲装置:称30.0gNaOH固体 B. 乙装置:过滤除去溶液中的不溶性杂质
C. 丙装置:除去CO2中混有的HCl气体 D. 丁装置:吸收实验室制NH3的尾气
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com