
【题目】下图是某元素的价类二维图,A为正盐,通常条件下Z是无色溶液,D的相对分子质量比E小16,各物质转化关系如图所示。下列说法不正确的是
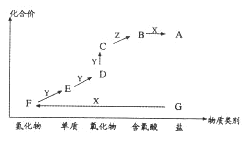
A.若X是一种强碱,则F为硝酸
B.若X是一种强酸,则F为硫酸
C.B和F在一定条件下均能发生反应,且都生成
D.B在一定条件下可直接与Y反应生成D
【答案】C
【解析】
A为正盐,若X是一种强碱,二者反应生成氢化物B,则A为铵盐、B为NH3,B连续与Y反应依次得到单质C、氧化物D与氧化物E,D的相对分子质量比E小16,则Y为O2、C为N2、D为NO、E为NO2,通常条件下Z是无色液体,E与Z反应得到含氧酸F,则Z为H2O、F为HNO3.若X是一种强酸,为S元素单质及其化合物符合转化关系,则A为硫化物、B为H2S、C为S、D为SO2、E为SO3、Z为、F为H2SO4。
A.A为正盐,若X是一种强碱,二者反应生成氢化物B,则A为铵盐、B为NH3,B连续与Y反应依次得到单质C、氧化物D与氧化物E,D的相对分子质量比E小16,则Y为O2、C为N2、D为NO、E为NO2,通常条件下Z是无色液体,E与Z反应得到含氧酸F,则Z为H2O、F为HNO3,故A正确;
B.若X是一种强酸,为S元素单质及其化合物符合转化关系,则A为硫化物、B为H2S、C为S、D为SO2、E为SO3、Z为、F为H2SO4,故B正确;
C.氨气与硝酸反应生成硝酸铵,但硫化氢与硫酸反应不能生成盐,故C错误;
D.氨气能与氧气反应生成NO与水,硫化氢能与氧气反应生成二氧化硫,故D正确;
故答案为C。


科目:高中化学 来源: 题型:
【题目】在太空中发现迄今已知最大钻石 直径4000公里,重达100亿万亿万亿克拉。下列关于金刚石的叙述说法正确的是:( )
A.含1molC的金刚石中的共价键为4mol
B.金刚石和石墨是同分异构体
C.C(石墨)![]() C(金刚石) △H=+1.9KJ/mol,说明金刚石比石墨稳定
C(金刚石) △H=+1.9KJ/mol,说明金刚石比石墨稳定
D.石墨转化为金刚石是化学变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为药用有机物,存在如图所示的转化关系。已知A在一定条件下能跟醇发生酯化反应,A分子中苯环上的两个取代基处于邻位,D能跟NaOH溶液反应。
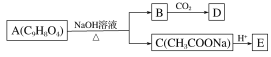
请回答:
(1)A转化为B、C时,涉及的反应类型有____________________________________、_______________。
(2)E的两种同分异构体Q、R都能在一定条件下发生银镜反应,R能与Na反应放出H2,而Q不能。Q、R的结构简式为Q________________;R________________。
(3)D的结构简式为____________。
(4)写出A在加热条件下与NaOH溶液反应的化学方程式:______________________。
(5)已知:![]()
![]()
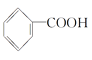 请选用适当物质设计一种合成方法。用邻甲基苯酚经两步反应合成有机物A,在方框中填写有机物的结构简式。
请选用适当物质设计一种合成方法。用邻甲基苯酚经两步反应合成有机物A,在方框中填写有机物的结构简式。![]()
![]()
![]()
![]() 有机物A。
有机物A。
___________; ____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是元素周期表的一部分,其中X、Y、Z均为短周期元素,它们的位置关系如图所示,已知三种元素的质子数之和为31,写出:
X | ||
Y | Z |
(1)写出X、Y、Z的元素符号:___、___、___。
(2)写出Y元素的离子结构示意图:___。
(3)元素Y和Z的金属性较强的是___(填元素符号)。
(4)Z是大自然赐予人类的宝物。它其中的一个用途是和氧化铁反应制得难熔金属铁,该反应的化学方程式为___,Z表现出的性质是___(氧化性/还原性),反应时可观察到的实验现象有___(填字母)。
A.产生红棕色烟雾 B.发出耀眼的光芒 C.有熔融物生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验能达到实验目的的是( )
序号 | 实验内容 | 实验目的 |
A | 盛有 | 探究浓度对反应速率的影响 |
B | 向3 mL KI溶液中滴加几滴溴水,振荡,再滴加1mL淀粉溶液,溶液显蓝色 | 比较Br2 和I2的氧化性强弱 |
C | 在容积可变的密闭容器中发生反应:2NO2(g) | 正反应速率加快,逆反应速率减慢 |
D | 向2支试管中各加入相同体积、相同浓度的 | 探究温度对反应速率的影响 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是几种常见的化学电源示意图,有关说法不正确的是( )

A. 上述电池分别属于一次电池、二次电池和燃料电池
B. 干电池在长时间使用后,锌筒被破坏
C. 氢氧燃料电池是一种具有应用前景的绿色电源
D. 铅蓄电池工作过程中,每通过2mol电子,负极质量减轻207g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I、实验室用50 mL 0.50 mol·L-1盐酸、50 mL 0.55 mol·L-1 NaOH溶液和如图所示装置,进行测定中和热的实验,得到表中的数据:完成下列问题:
实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | |
盐酸 | NaOH溶液 | ||
1 | 20.2 | 20.3 | 23.7 |
2 | 20.3 | 20.5 | 23.8 |
3 | 21.5 | 21.6 | 24.9 |

(1)不能用铁丝搅拌棒代替环形玻璃搅拌棒的理由是_______
(2)经数据处理,测得中和热为56.8 kJ·mol-1其热化学方程式为:___________
II.实验室制备硝基苯实验装置和步骤如下:(实验步骤)

取100 mL烧杯,用20 mL浓硫酸与18 mL浓硝酸配制混合液,将混合酸小心加入B中,把18 mL(15.84 g)苯加入A中。向室温下的苯中逐滴加入混酸,边滴边搅拌,混合均匀,在50~60℃下发生反应,直至反应结束。
将反应液冷却至室温后倒入分液漏斗中,依次用少量水、5% NaOH溶液和水洗涤。分出的产物加入无水CaCl2颗粒,静置片刻,弃去CaCl2,进行蒸馏纯化,收集205~210 ℃馏分,得到纯硝基苯18.00 g。请回答:
(1)装置B的名称是________,装置C的作用是________________。
(2)实验室制备硝基苯的化学方程式是____________________________。
(3)为了使反应在50~60 ℃下进行,常用的方法是__________。
(4)在洗涤操作中,第二次水洗的作用是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将mg铜粉和锌粉的混合物分成两等份,将其中一份加入200mL的稀硝酸中并加热,固体和硝酸恰好完全反应,并产生标准状况下的NO2.24L(标准状况下);将另一份在空气中充分加热,的到n g固体,将所得固体溶于上述稀硝酸,消耗硝酸的体积为V ml。下列说法不正确的是
A.V=150Ml
B.硝酸的浓度为2 mol·L-1
C.m g铜粉和锌粉的物质的量之和为0.3 mol
D.n=m+2.4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2资源化利用的方法之一是合成二甲醚(CH3OCH3)。
(1)CO2 催化加氢合成二甲醚的过程中主要发生下列反应:
反应I: CO2(g) + H2(g) ![]() CO(g) + H2O(g) H= + 41.2 kJ·mol1
CO(g) + H2O(g) H= + 41.2 kJ·mol1
反应II:2CO2(g) + 6H2(g) ![]() CH3OCH3(g) + 3H2O(g) H = -122.5 kJ·mol1
CH3OCH3(g) + 3H2O(g) H = -122.5 kJ·mol1
其中,反应II分以下①、②两步完成,请写出反应①的热化学方程式:①___________
② 2CH3OH(g) ![]() CH3OCH3(g) + H2O(g) H = -23.5 kJ·mol1
CH3OCH3(g) + H2O(g) H = -23.5 kJ·mol1
(2)二甲醚直接燃料电池具有启动快、效率高等优点。若电解质为碱性,二甲醚直接燃料电池的负极反应式为____________。以该电池为电源,用惰性电极电解饱和食盐水的化学方程式为________。
(3)反应I产生的CO,有人设想按下列反应除去:2CO(g) = 2C(s) + O2(g),已知该反应的H>0,简述该设想能否实现的依据_____________。
(4)CO2在自然界循环时可与CaCO3反应,Ksp(CaCO3)=2.8×109。 CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为5.6×105mol·L1,则生成沉淀所需CaCl2溶液的最小浓度为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com