
����Ŀ��CO2��Դ�����õķ���֮һ�Ǻϳɶ����ѣ�CH3OCH3����
��1��CO2 ������ϳɶ����ѵĹ�������Ҫ�������з�Ӧ��
��ӦI�� CO2(g) + H2(g) ![]() CO(g) + H2O(g) H= + 41.2 kJ��mol1
CO(g) + H2O(g) H= + 41.2 kJ��mol1
��ӦII��2CO2(g) + 6H2(g) ![]() CH3OCH3(g) + 3H2O(g) H = ��122.5 kJ��mol1
CH3OCH3(g) + 3H2O(g) H = ��122.5 kJ��mol1
���У���ӦII�����¢١���������ɣ���д����Ӧ�ٵ��Ȼ�ѧ����ʽ����___________
�� 2CH3OH(g) ![]() CH3OCH3(g) + H2O(g) H = ��23.5 kJ��mol1
CH3OCH3(g) + H2O(g) H = ��23.5 kJ��mol1
��2��������ֱ��ȼ�ϵ�ؾ��������졢Ч�ʸߵ��ŵ㡣�������Ϊ���ԣ�������ֱ��ȼ�ϵ�صĸ�����ӦʽΪ____________���Ըõ��Ϊ��Դ���ö��Ե缫��ⱥ��ʳ��ˮ�Ļ�ѧ����ʽΪ________��
��3����ӦI������CO���������밴���з�Ӧ��ȥ��2CO(g) �� 2C(s) + O2(g)����֪�÷�Ӧ��H��0�������������ܷ�ʵ�ֵ�����_____________��
��4��CO2����Ȼ��ѭ��ʱ����CaCO3��Ӧ��Ksp��CaCO3��=2.8��109�� CaCl2��Һ��Na2CO3��Һ��Ͽ��γ�CaCO3�������ֽ��������CaCl2��Һ��Na2CO3��Һ��ϣ���Na2CO3��Һ��Ũ��Ϊ5.6��105mol��L1�������ɳ�������CaCl2��Һ����СŨ��Ϊ________��
���𰸡�CO2(g) + 3H2(g) CH3OH(g) + H2O(g)��H =-49.5 kJ��mol1 CH3OCH3+16OH--12e-=2CO32-+11H2O 2NaCl+2H2O![]() 2NaOH+Cl2��+H2�� �÷�Ӧ���������ؼ��ķ�Ӧ�����ݡ�G=��H-T��S��֪��G��0������ʵ�� 210-4mol/L
2NaOH+Cl2��+H2�� �÷�Ӧ���������ؼ��ķ�Ӧ�����ݡ�G=��H-T��S��֪��G��0������ʵ�� 210-4mol/L
��������
��1�������֪��ӦII�����¢١���������ɣ����ݸ�˹���ɣ�������ʽ��II-�ڣ�![]() �÷���ʽ�٣�CO2(g)+3H2(g)CH3OH(g)+H2O(g)��H=
�÷���ʽ�٣�CO2(g)+3H2(g)CH3OH(g)+H2O(g)��H=![]() kJ��mol1=-49.5kJ��mol1��
kJ��mol1=-49.5kJ��mol1��
��2���������Ϊ���ԣ�����������������ԭ��Ӧ��O2+2H2O+4e-=4OH-��������ֱ��ȼ�ϵ�صĸ�����ӦΪ������ʧ�������ɶ�����̼������Һ������̼���Σ����ԭ���غ�͵���غ㣬�����ĵ缫��ӦʽΪ��CH3OCH3+16OH--12e-=2CO32-+11H2O���ö��Ե缫��ⱥ��ʳ��ˮ�������������������������������������ƣ����Ļ�ѧ����ʽΪ��2NaCl+2H2O![]() 2NaOH+Cl2��+H2����
2NaOH+Cl2��+H2����
��3��2CO(g)��2C(s)+O2(g)H��0���÷�Ӧ���������ؼ��ķ�Ӧ�����ݡ�G=��H-T��S��֪��G��0������ʵ�֣�
��4��Na2CO3��Һ��Ũ��Ϊ5.6��105mol��L1���������Ϻ�Ũ�ȼ�Сһ���Ϊ2.8��105mol��L1����Ksp(CaCO3)=c(CO32-)c(Ca2+)��֪����Ϻ�c(Ca2+)=![]() =
=![]() =110-4mol/L����������CaCl2��Һ����СŨ��Ϊ110-4mol/L2=210-4mol/L��
=110-4mol/L����������CaCl2��Һ����СŨ��Ϊ110-4mol/L2=210-4mol/L��


 ÿ��10���ӿ�����������������ϵ�д�
ÿ��10���ӿ�����������������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ijԪ�صļ����άͼ��AΪ���Σ�ͨ��������Z����ɫ��Һ��D����Է���������EС16��������ת����ϵ��ͼ��ʾ������˵������ȷ����
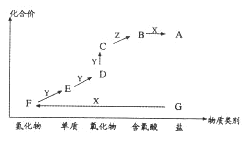
A.��X��һ��ǿ���FΪ����
B.��X��һ��ǿ�ᣬ��FΪ����
C.B��F��һ�������¾��ܷ�����Ӧ���Ҷ�����
D.B��һ�������¿�ֱ����Y��Ӧ����D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���1 L 0.1 mol��L��1һԪ��HR��Һ����ͨ�백������֪������NH3��H2O����ƽ�ⳣ��K��1.76��10��5�ݣ�ʹ��Һ�¶Ⱥ�������ֲ��䣬�����Һ��pH������Ũ�ȱ仯�Ĺ�ϵ����ͼ��ʾ������������ȷ����

A. 0.1 mol��L��1 HR��Һ��pHΪ5
B. HRΪ���ᣬ����ʱ���Ű�����ͨ�룬c(R��)/[c(OH��).c(HR)] ������
C. ��ͨ��0.1 mol NH3ʱ��c(NH4+)��c(R��)��c(OH��)��c(H+)
D. ��c(R��)�� c(HR)ʱ����Һ��Ϊ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������ԭ�Ӿ�����ԭ������
A.SO3��H2O��Ӧ��ȡ����:SO3+H2O=H2SO4
B.������������Һ����SO2:SO2+2NaOH=Na2SO3+H2O
C.CO2��H2��Ӧ��ȡ�״�:CO2+3H2 CH3OH+H2O
CH3OH+H2O
D.H2��ԭ����ͭ:H2+CuO![]() Cu+H2O
Cu+H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���л���Y(��������������������)���п����������������ã����ɻ�����X��һ�������ºϳɣ�
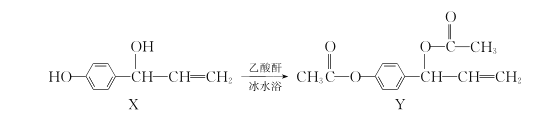
����˵����ȷ����
A.Y����3�ֲ�ͬ������
B.X��Y�����о����е�����̼ԭ��������ͬ
C.1molX����ˮ��ַ�Ӧ���������Br2�����ʵ���Ϊ2mol
D.1molY��NaOH��Һ��ַ�Ӧ���������NaOH�����ʵ���Ϊ3mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��Һ�д���ƽ�⣺Ca(OH)2(s)![]() Ca2��(aq)��2OH-(aq) ��H<0�������йظ�ƽ����ϵ��˵����ȷ���ǣ� ��
Ca2��(aq)��2OH-(aq) ��H<0�������йظ�ƽ����ϵ��˵����ȷ���ǣ� ��
�������¶ȣ�ƽ�������ƶ� ������Һ�м�������̼���Ʒ�ĩ����������ӵ�Ũ��
�۳�ȥ�Ȼ�����Һ�л��е����������ӣ���������Һ�м���������NaOH��Һ
�ܺ����£�����Һ�м���CaO����Һ��pH����
������Һ�м�������NaOH���壬Ca(OH)2������������
������Һ�м���Na2CO3��Һ�����й�����������
A.�٢�B.�٢ݢ�C.�ڢۢܢ�D.�٢ڢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijͬѧ����Ӱ�������Һ��������������Һ��Ӧ�������ص��о��������£�ʵ���������£�
ʵ����� | �� | �� | �� |
�����Լ� | 4mL 0.01mol/L KMnO4 2mL 0.1mol/L H2C2O4 | 4mL 0.01mol/L KMnO4 2mL 0.1mol/L H2C2O4 ����MnSO4���� | 4mL 0.01mol/L KMnO4 2mL 0.1mol/L H2C2O4 ����Na2SO4���� |
��ɫʱ��/s | 116 | 6 | 117 |
��1��������Һ��������������Һ��Ӧ�����ӷ���ʽΪ___________________��
��2����ʵ�������_______________________��
��3��������������ʵ���ͬѧ���з�˼����Ϊʵ��ٵ��������֤���������ۡ���д��ʵ��ٵ�����Ϊ____________________��
��4��ʵ���ѡ��MnSO4���������MnCl2�����ԭ����_________________��
��5����ͬѧ���������ͼ��ʾ��ʵ�鷽������̽����������Է�Ӧ���ʵ�Ӱ�졣

a����ͬѧ���о���Ӱ��������___________________��
b������Ϊ��ͬѧ��ʵ�鷽��_______________���������������������������____________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��п��һ�ֳ��ý�������ҵ������п��ɰ(��Ҫ��ZnO��ZnFe2O4������������CaO��FeO��CuO��NiO �ȣ�ʪ����ȡ����п��������ͼ��ʾ���ش��������⡣

��֪��Fe�Ļ�����ǿ��Ni��
��1��ZnFe2O4��д��ZnOFe2O3����ZnFe2O4��H2SO4��Ӧ�Ļ�ѧ����ʽ___��
��2��������������������
�ٽ���Һ�������� Fe2+�����������Լ��п�ѡ�õ���_____(����ĸ��ţ���
A��������ˮ B��30 % H2O2��Һ C��FeC13��Һ D��KMnO4��Һ
�ڼ���ZnO��������ҺpHΪ3.3~6.7�����ȵ�60�����Ҳ����Ͻ��裬���Ƚ�����ҪĿ����___��
��3�������������ɵij����л�������Һ�е��������ʣ���Һ�е��������ʱ���ͬ������ԭ����____��
��4�����������м������Zn��Ŀ����______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����0.1 mol��L��1 NaOH��Һ�ζ�40 mL 0.1 mol��L��1 H2SO3��Һ�����õζ�������ͼ��ʾ�����Ի��ʱ��Һ����ı仯������������������ǣ� ��
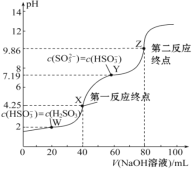
A. Ka2(H2SO3)��������Ϊ10��8
B. ���ζ�����һ��Ӧ�յ㣬���ü�����ָʾ��
C. ͼ��Z���Ӧ����Һ�У�c(Na��)>c(SO32��)>c(HSO3��)>c(OH��)
D. ͼ��Y���Ӧ����Һ�У�3c(SO32��)��c(Na��)��c(H��)��c(OH��)
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com