
【题目】某同学进行影响草酸溶液与高锰酸钾酸性溶液反应速率因素的研究。室温下,实验数据如下:
实验序号 | ① | ② | ③ |
加入试剂 | 4mL 0.01mol/L KMnO4 2mL 0.1mol/L H2C2O4 | 4mL 0.01mol/L KMnO4 2mL 0.1mol/L H2C2O4 少量MnSO4固体 | 4mL 0.01mol/L KMnO4 2mL 0.1mol/L H2C2O4 少量Na2SO4固体 |
褪色时间/s | 116 | 6 | 117 |
(1)草酸溶液与高锰酸钾酸性溶液反应的离子方程式为___________________。
(2)该实验结论是_______________________。
(3)进行上述三个实验后,该同学进行反思,认为实验①的现象可以证明上述结论。请写出实验①的现象为____________________。
(4)实验②选用MnSO4固体而不是MnCl2固体的原因是_________________。
(5)该同学拟采用如下图所示的实验方案继续探究外界条件对反应速率的影响。

a.该同学拟研究的影响因素是___________________。
b.你认为该同学的实验方案_______________(填“合理”或“不合理”),理由是____________________________。
【答案】5H2C2O4+2MnO4-+6H+=2Mn2++8H2O+10CO2↑ 在其他条件相同时,Mn2+是草酸与酸性高锰酸钾反应的催化剂,起着加快反应速率的作用 高锰酸钾溶液褪色的速率开始比较缓慢,一段时间后突然加快,因为反应生成的MnSO4是草酸与酸性高锰酸钾反应的催化剂,能加快化学反应速率 酸性高锰酸钾溶液具有强氧化性,能氧化氯化锰中的氯离子,同时使酸性高锰酸钾溶液褪色,从而缩短褪色时间,对实验产生干扰 KMnO4溶液的浓度对反应速率的影响 不合理 KMnO4溶液浓度不同,开始反应时溶液的起始颜色深浅不同,无法通过比较褪色的时间长短来判断反应快慢
【解析】
(1)酸性高锰酸钾溶液和草酸反应生成锰离子、二氧化碳,由质量守恒、电荷守恒可知该反应的离子方程式为:5H2C2O4+2MnO4-+6H+=2Mn2++8H2O+10CO2↑;
(2)实验实验①②③中反应物都是KMnO4和H2C2O4,都在室温下反应,说明浓度相同,温度相同,高锰酸钾褪色最快的是②,加入了硫酸锰,③中加的是硫酸钠与①褪色时间基本相同,对比得知起催化作用的是Mn2+;故答案为:在其他条件相同时,Mn2+是草酸与酸性高锰酸钾反应的催化剂,起着加快反应速率的作用;
(3)实验②是单独加入催化剂MnSO4,而草酸与酸性高锰酸钾反应本身是会生成MnSO4的,那么这个反应的产物就会起到催化剂的作用,所以实验①的现象为:高锰酸钾溶液褪色的速率开始比较缓慢,一段时间后突然加快,因为反应生成的MnSO4是草酸与酸性高锰酸钾反应的催化剂,能加快化学反应速率;答案为:高锰酸钾溶液褪色的速率开始比较缓慢,一段时间后突然加快,因为反应生成的MnSO4是草酸与酸性高锰酸钾反应的催化剂,能加快化学反应速率;
(4)酸性高锰酸钾溶液具有强氧化性,能氧化氯化锰中的氯离子,同时使酸性高锰酸钾溶液褪色,从而缩短褪色时间,对实验产生干扰;
(5)a.根据实验方案中KMnO4溶液的浓度不同可知该实验研究的是KMnO4溶液的浓度对反应速率的影响;
b.反应的速率通过KMnO4溶液颜色的变化来判断,但两个实验中KMnO4的浓度不同,开始反应时溶液的起始颜色深浅不同,无法通过比较褪色的时间长短来判断反应快慢,因此该方案不合理;答案为:不合理;KMnO4溶液浓度不同,开始反应时溶液的起始颜色深浅不同,无法通过比较褪色的时间长短来判断反应快慢。


科目:高中化学 来源: 题型:
【题目】I、实验室用50 mL 0.50 mol·L-1盐酸、50 mL 0.55 mol·L-1 NaOH溶液和如图所示装置,进行测定中和热的实验,得到表中的数据:完成下列问题:
实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | |
盐酸 | NaOH溶液 | ||
1 | 20.2 | 20.3 | 23.7 |
2 | 20.3 | 20.5 | 23.8 |
3 | 21.5 | 21.6 | 24.9 |

(1)不能用铁丝搅拌棒代替环形玻璃搅拌棒的理由是_______
(2)经数据处理,测得中和热为56.8 kJ·mol-1其热化学方程式为:___________
II.实验室制备硝基苯实验装置和步骤如下:(实验步骤)

取100 mL烧杯,用20 mL浓硫酸与18 mL浓硝酸配制混合液,将混合酸小心加入B中,把18 mL(15.84 g)苯加入A中。向室温下的苯中逐滴加入混酸,边滴边搅拌,混合均匀,在50~60℃下发生反应,直至反应结束。
将反应液冷却至室温后倒入分液漏斗中,依次用少量水、5% NaOH溶液和水洗涤。分出的产物加入无水CaCl2颗粒,静置片刻,弃去CaCl2,进行蒸馏纯化,收集205~210 ℃馏分,得到纯硝基苯18.00 g。请回答:
(1)装置B的名称是________,装置C的作用是________________。
(2)实验室制备硝基苯的化学方程式是____________________________。
(3)为了使反应在50~60 ℃下进行,常用的方法是__________。
(4)在洗涤操作中,第二次水洗的作用是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】PET(聚对二苯甲酸乙二醇酯)是制备医用防护服的重要材料。以石油作为原料合成PET中间体的流程如图:
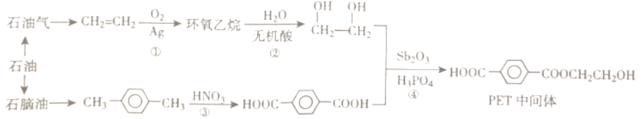
(1)环氧乙烷的分子式为C2H4O,分子中存在一个环状结构。环氧乙烷的结构简式为___,环氧乙烷有多种同分异构体,下列结构与环氧乙烷互为同分异构体的是___ (填代号)
a.CH3CHO b.HOCH2CH2OOH c.CH2=CHOH
(2)反应②的产物是乙二醇。乙二醇属于醇类化合物,性质与乙醇类似。乙二醇的官能团是___。(填名称或者结构简式)
(3)从石脑油中可以提炼出对二甲苯(![]() )。对二甲苯的分子式为___。对二甲苯在浓硫酸和浓硝酸存在的条件下,可以在苯环上形成硝基取代产物(分子式为C8H8N2O4),该硝基取代产物的所有可能的结构简式为___。
)。对二甲苯的分子式为___。对二甲苯在浓硫酸和浓硝酸存在的条件下,可以在苯环上形成硝基取代产物(分子式为C8H8N2O4),该硝基取代产物的所有可能的结构简式为___。
(4)反应④的化学方程式为___。该反应的反应类型为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2资源化利用的方法之一是合成二甲醚(CH3OCH3)。
(1)CO2 催化加氢合成二甲醚的过程中主要发生下列反应:
反应I: CO2(g) + H2(g) ![]() CO(g) + H2O(g) H= + 41.2 kJ·mol1
CO(g) + H2O(g) H= + 41.2 kJ·mol1
反应II:2CO2(g) + 6H2(g) ![]() CH3OCH3(g) + 3H2O(g) H = -122.5 kJ·mol1
CH3OCH3(g) + 3H2O(g) H = -122.5 kJ·mol1
其中,反应II分以下①、②两步完成,请写出反应①的热化学方程式:①___________
② 2CH3OH(g) ![]() CH3OCH3(g) + H2O(g) H = -23.5 kJ·mol1
CH3OCH3(g) + H2O(g) H = -23.5 kJ·mol1
(2)二甲醚直接燃料电池具有启动快、效率高等优点。若电解质为碱性,二甲醚直接燃料电池的负极反应式为____________。以该电池为电源,用惰性电极电解饱和食盐水的化学方程式为________。
(3)反应I产生的CO,有人设想按下列反应除去:2CO(g) = 2C(s) + O2(g),已知该反应的H>0,简述该设想能否实现的依据_____________。
(4)CO2在自然界循环时可与CaCO3反应,Ksp(CaCO3)=2.8×109。 CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为5.6×105mol·L1,则生成沉淀所需CaCl2溶液的最小浓度为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】激素类药物己烯雌酚的结构简式如图所示。下列叙述正确的是

A.己烯雌酚是芳香烃
B.1mol己烯雌酚可与6molH2发生加成反应
C.1mol己烯雌酚完全燃烧能生成18molCO2和12 molH2O
D.己烯雌酚苯环上的一氯代物有两种(不包括立体异构)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知可逆反应aA2 +bB2![]() xX(反应物、生成物都是气体)。回答下列问题:
xX(反应物、生成物都是气体)。回答下列问题:
I.将一定量的两种反应物置于恒容绝热反应器中(与外部环境无热量交换的反应器),反应器内的温度与时间的关系如图:

(1)该反应是___ (填“吸”或“ 放”)热反应。
(2)下列关于该反应的叙述正确的是____ (填字母)。
a A点反应停止 b A点速率不为零
c 反应物的总能量大于生成物的 d B点正反应速率大于逆反应速率
II.将一定量的上述反应的反应物与生成物置于容积为2L的恒温恒容反应器中,反应器中各物质的物质的量与时间的关系如图:

(3)①反应前4 min物质x的物质的量的变化为_____mol. .
②反应前4 min物质A2反应速率为_______
③该可逆反应的化学方程式为______(物质X用A、B表示)。
④如果在4 min时升高反应体系的温度.则反应速率___ ( 填“增大“减小”或“不变")。
⑤如果在4min时加入2.4 mol Ne(Ne不参与该反应),则反应速率___ (填“增大”“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着科技的进步,合理利用资源、保护环境成为当今社会关注的焦点。甲胺铅碘(CH3NH3PbI3)用作全固态钙钛矿敏化太阳能电池的敏化剂,可由CH3NH2、PbI2及HI为原料合成,制取甲胺的反应为CH3OH(g)+NH3(g)![]() CH3NH2(g)+H2O(g) ΔH。回答下列问题:
CH3NH2(g)+H2O(g) ΔH。回答下列问题:
(1)上述反应中所需的甲醇工业上利用水煤气合成,已知
①CO(g)+![]() O2(g)═CO2(g) △H1=-284kJ/mol
O2(g)═CO2(g) △H1=-284kJ/mol
②H2(g)+![]() O2(g)═H2O(g) △H2=-248kJ/mol
O2(g)═H2O(g) △H2=-248kJ/mol
③CH3OH(g)+![]() O2(g)═CO2(g)+2H2O(g) △H3=-651kJ/mol
O2(g)═CO2(g)+2H2O(g) △H3=-651kJ/mol
CO(g)+2H2(g)![]() CH3OH(g)ΔH=___。
CH3OH(g)ΔH=___。
(2)在一定条件下,将1molCO和2molH2通入密闭容器中进行反应,当改变某一外界条件(温度或压强)时,CH3OH的体积分数φ(CH3OH)变化趋势如图所示:
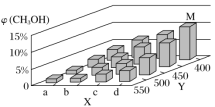
①平衡时,M点CH3OH的体积分数为10%,则CO的转化率为____。
②X轴上b点的数值比a点___(填“大”或“小”)。某同学认为图中Y轴表示温度,你认为他判断的理由是___。
(3)实验室可由四氧化三铅和氢碘酸反应制备难溶的PbI2,常温下,PbI2饱和溶液(呈黄色)中c(Pb2+)=1.0×10-3mol·L-1,则Ksp(PbI2)=___;已知Ksp(PbCl2)=1.6×10-5,则转化反应PbI2(s)+2Cl-(aq)![]() PbCl2(s)+2I-(aq)的平衡常数K=___。
PbCl2(s)+2I-(aq)的平衡常数K=___。
(4)分解HI曲线和液相法制备HI反应曲线分别如图1和图2所示:
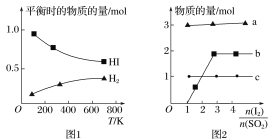
①反应H2(g)+I2(g)![]() 2HI(g)的ΔH__(填大于或小于)0。
2HI(g)的ΔH__(填大于或小于)0。
②将二氧化硫通入碘水中会发生反应:SO2+I2+2H2O![]() 3H++HSO4-+2I-,I2+I-
3H++HSO4-+2I-,I2+I-![]() I3-,图2中曲线a、b分别代表的微粒是___、___(填微粒符号);由图2知要提高碘的还原率,除控制温度外,还可以采取的措施是___。
I3-,图2中曲线a、b分别代表的微粒是___、___(填微粒符号);由图2知要提高碘的还原率,除控制温度外,还可以采取的措施是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.甲硅烷(SiH4)常温下是一种无色气体,遇空气发生自燃。
(1)甲硅烷中含有的化学键是___,其在固态时属于___晶体。
(2)室温下1g甲硅烷燃烧生成SiO2和H2O放热44.6kJ,其热化学方程式为___。
Ⅱ.①CaCO3(s)=CaO(s)+CO2(g) △H=178.2kJmol-1
②2Na(s)+Cl2(g)=2NaCl(s) △H=-822.0kJmol-1
则:
(3)上述反应①②中属于放热反应的是___(填序号)。
(4)根据②计算生成1molNaCl(s)时,△H=___kJmol-1
Ⅲ.氢氧燃料电池是符合绿色化学理念的新型发电装置。如图为电池示意图。该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定。请回答:
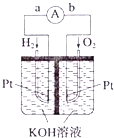
(5)氢氧燃料电池的能量转化形式主要是___。在导线中电子流动方向为___(用a、b表示)。
(6)负极反应式为___。
(7)金属锂是一种重要的储氢材料,吸氢和放氢原理如下:2Li+H2=2LiH,LiH+H2O=LiOH+H2↑,则2mol锂储氢后释放出的H2可以消耗标准状态O2的体积是___L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜及其化合物在工业生产和日常生活中有着广泛的应用。
某化学小组拟采用如下装置(夹持和加热仪器已略去)来测定铜的相对原子质量,同时检验氯气的氧化性。
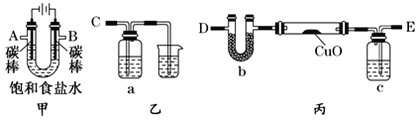
(1)装置甲中发生反应的化学方程式是:__________。
(2)已知装置甲中B处有黄绿色的气体产生,且 B连C ;则A连________(填写连接的字母)。
(3)乙装置的a瓶中溶液可以是________(填标号)
A 酸性KMnO4溶液 B CCl4溶液 C 滴加有KSCN溶液的FeCl2溶液 D 饱和食盐水
(4)在检查装置气密性后,加热丙装置硬质玻璃管里的CuO粉末前,还需要进行的操作为________。
(5)准确称量m g CuO进行实验,当CuO完全反应后测出b中增重n g。则Cu的相对原子质量为____________(只要求列出算式)。该实验方案的装置有不合理之处,若不加以改进会导致测定结果__________ (填“偏大”、“偏小”或“不变”)。
(6)利用焰色反应的原理既可制作五彩缤纷的节日烟花,亦可定性鉴别某些金属盐。灼烧CuCl2样品时,铜的焰色为__________(填标号)。
A 绿色 B 红色 C 紫色 D 黄色
(7)向CuCl2溶液中通人H2S气体,可产生CuS沉淀,反应离子方程式为:Cu2+ + H2S=CuS(s) + 2H+,则该反应的平衡常数K=_________(保留一位小数)。已知:CuS溶度积Ksp=1.0×10-36,H2S电离常数Ka1=1.3×10-7,Ka2=7.0×10-15。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com