
【题目】激素类药物己烯雌酚的结构简式如图所示。下列叙述正确的是

A.己烯雌酚是芳香烃
B.1mol己烯雌酚可与6molH2发生加成反应
C.1mol己烯雌酚完全燃烧能生成18molCO2和12 molH2O
D.己烯雌酚苯环上的一氯代物有两种(不包括立体异构)
 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案科目:高中化学 来源: 题型:
【题目】I、(1)普通锌锰干电池的结构如图所示。回答下列问题。

①电池中电解质溶液为________。
②负极反应式为______________________________________。
③放电时NH![]() 向________(填“正极”或“负极”)移动。
向________(填“正极”或“负极”)移动。
(2)废电池中的锌皮常用于实验室制氢气,废锌皮和纯锌粒分别与同浓度的稀硫酸反应,产生氢气速率较大的是________,若用过量的纯锌粒与一定量的稀硫酸反应,为了加快反应速率又不影响产生氢气的量,下列措施可行的是________(填序号)。
A.微热 B.加入适量氧化铜 C.加入少量硫酸铜溶液
D.加水 E.加入少量氢氧化钡溶液
II、一定条件下,H2O2在水溶液中发生分解反应:2H2O2![]() 2H2O+O2↑,反应过程中,测得不同时间H2O2的物质的量浓度如下表:
2H2O+O2↑,反应过程中,测得不同时间H2O2的物质的量浓度如下表:
t/min | 0 | 20 | 40 | 60 | 80 |
c(H2O2)/(mol/L) | 0.80 | 0.40 | 0.20 | 0.10 | 0.05 |
(1)H2O2的分解反应________氧化还原反应(填“是”或“不是”)。
(2)该分解反应0~20 min的平均反应速率v(H2O2)为________ mol/(L·min)。
(3) 加入0.1 mol的MnO2粉末于50 mL过氧化氢的溶液中(密度为1.1 g/mL),在标准状况下放出气体的体积和时间的关系如图所示,反应放出![]() 气体所需要的时间为________;A、B、C、D四点化学反应速率快慢的顺序为________。
气体所需要的时间为________;A、B、C、D四点化学反应速率快慢的顺序为________。

(4)由合成气(组成为H2、CO、和少量CO2)直接制备二甲醚,其中主要过程包括以下四个反应:
甲醇合成反应:①CO(g)+ 2H2(g)=CH3OH(g) ΔH1=-90.1 kJ·mol-1
②CO2(g)+ 3H2(g)=CH3OH(g)+H2O(g) ΔH2=-49.0 kJ·mol-1
水煤气变换反应:③CO(g) + H2O (g)=CO2(g)+H2(g) ΔH3=-41.1 kJ·mol-1
二甲醚合成反应:
由H2和CO直接制备二甲醚(另一产物为水蒸气)的热化学方程式为________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,在20mL0.lmol/LNa2CO3溶液中逐滴加入40mL0.l mol/L 稀盐酸,溶液中含碳元素各种微粒(CO2因逸出未画出)的物质的量分数(纵轴)随溶液pH变化的部分情况如图所示。下列说法正确的是

A.曲线a表示H2CO3的变化曲线
B.H2CO3、HCO3-、CO32-可大量共存于同一溶液中
C.pH=11时,c(HCO3-)>c(Cl-)
D.碳酸钠溶液的水解平衡常数为1.0×10-11
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物Y(乙酰氧基胡椒酚乙酸酯)具有抗氧化、抗肿瘤作用,可由化合物X在一定条件下合成:
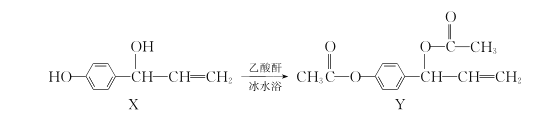
下列说法正确的是
A.Y中有3种不同官能团
B.X、Y分子中均含有的手性碳原子数不相同
C.1molX与溴水充分反应,最多消耗Br2的物质的量为2mol
D.1molY与NaOH溶液充分反应,最多消耗NaOH的物质的量为3mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水中含有丰富的矿物资源,很多以离子状态存在。今人重视海洋资源的利用,从海洋中获取了多种物质。如图是以海水为原料获取几种物质的流程图:

已知Br2在碱性溶液中不能稳定存在。回答下列问题:
(1)步骤②的操作名称为__
(2)步骤②的实现需要向氯化钠溶液中通入CO2、NH3,应先通入_____
(3)步骤⑥的化学方程式为_______步骤⑨的离子方程式为_______
(4)步骤⑧的目的是_____
(5)步骤为萃取分液,需要用到的萃取试剂可以为____(填字母),需要用到的玻璃仪器名称为__
a 裂化汽油 b 苯 c 酒精 d 四氯化碳
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学进行影响草酸溶液与高锰酸钾酸性溶液反应速率因素的研究。室温下,实验数据如下:
实验序号 | ① | ② | ③ |
加入试剂 | 4mL 0.01mol/L KMnO4 2mL 0.1mol/L H2C2O4 | 4mL 0.01mol/L KMnO4 2mL 0.1mol/L H2C2O4 少量MnSO4固体 | 4mL 0.01mol/L KMnO4 2mL 0.1mol/L H2C2O4 少量Na2SO4固体 |
褪色时间/s | 116 | 6 | 117 |
(1)草酸溶液与高锰酸钾酸性溶液反应的离子方程式为___________________。
(2)该实验结论是_______________________。
(3)进行上述三个实验后,该同学进行反思,认为实验①的现象可以证明上述结论。请写出实验①的现象为____________________。
(4)实验②选用MnSO4固体而不是MnCl2固体的原因是_________________。
(5)该同学拟采用如下图所示的实验方案继续探究外界条件对反应速率的影响。

a.该同学拟研究的影响因素是___________________。
b.你认为该同学的实验方案_______________(填“合理”或“不合理”),理由是____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各物质间的转化在给定条件下能实现的是( )
A.NH4HCO3![]() NH3
NH3![]() NO
NO
B.石油![]() CH3CH3
CH3CH3![]() CH2BrCH2Br
CH2BrCH2Br
C.稀HNO3![]() NO2
NO2![]() NO
NO
D.油脂![]() 葡萄糖
葡萄糖![]() 银镜
银镜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由Cu、N、B等元素组成的新型材料有着广泛用途。
(1)基态 Cu+ 的核外电子排布式为____________。在高温下CuO 能分解生成Cu2O,试从原子结构角度解释其原因:_______________________________。
(2)立方氮化硼是一种新型的超硬、耐磨、耐高温的结构材料,它属于____晶体。
(3)化合物A (H3BNH3) 是一种潜在的储氢材料,它可由六元环状化合物 (HB=NH)3通过3CH4+ 2 (HB=NH)3+ 6H2O →3CO2 + 6H3BNH3 制得。
①与上述化学方程式有关的叙述不正确的是_________。(填标号)
A.反应前后碳原子的轨道杂化类型不变 |
B.CH4、H2O、CO2分子空间构型分别是:正四面体形、V形、直线形 |
C.第一电离能:N>O>C>B |
D.化合物A中存在配位键 |
②1个 (HB=NH)3分子中有__个σ键。
(4)在硼酸盐中,阴离子有链状、环状等多种结构形式。图(a)是一种链状结构的多硼酸根,则多硼酸根离子符号为________。图(b)是硼砂晶体中阴离子的环状结构,其中硼原子采取的杂化类型为_________。


查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业中很多重要的原料都是来源于石油化工,根据转化关系,回答下列问题。

已知:A可用作植物生长调节剂、果实催熟剂。
(1)丙烯酸中含氧官能团的名称为___。
(2)若C为CH2BrCH2Br,反应①的反应类型为___。
(3)反应④的产物聚丙烯酸的结构简式为___。
(4)反应③的化学方程式为___。
(5)丙烯酸(CH2=CH-COOH)可能发生的反应有___(填序号)。
A.加成反应 B.缩聚反应 C.水解反应 D.氧化反应
(6)实验室制备丙烯酸乙酯的过程中,为了除去杂质丙烯酸,最佳的处理方法是___(填序号)。
a.加乙醇和浓硫酸,加热
b.用过量饱和碳酸钠溶液洗涤后分液
c.用过量氢氧化钠溶液洗涤后分液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com