
����Ŀ��I��ʵ������50 mL 0.50 mol��L��1���ᡢ50 mL 0.55 mol��L��1 NaOH��Һ����ͼ��ʾװ�ã����вⶨ�к��ȵ�ʵ�飬�õ����е����ݣ�����������⣺
ʵ����� | ��ʼ�¶�t1/�� | ��ֹ�¶�t2/�� | |
���� | NaOH��Һ | ||
1 | 20.2 | 20.3 | 23.7 |
2 | 20.3 | 20.5 | 23.8 |
3 | 21.5 | 21.6 | 24.9 |

(1)��������˿��������滷�β����������������_______
(2)�����ݴ���������к���Ϊ56.8 kJ��mol��1���Ȼ�ѧ����ʽΪ��___________
II��ʵ�����Ʊ�������ʵ��װ�úͲ������£�(ʵ�鲽��)

ȡ100 mL�ձ�����20 mLŨ������18 mLŨ�������ƻ��Һ���������С�ļ���B�У���18 mL(15.84 g)������A�С��������µı�����μ�����ᣬ�ߵα߽��裬��Ͼ��ȣ���50��60���·�����Ӧ��ֱ����Ӧ������
����ӦҺ��ȴ�����º����Һ©���У�����������ˮ��5% NaOH��Һ��ˮϴ�ӡ��ֳ��IJ��������ˮCaCl2����������Ƭ�̣���ȥCaCl2�������������ռ�205��210 ����֣��õ���������18.00 g����ش�
(1)װ��B��������________��װ��C��������________________��
(2)ʵ�����Ʊ��������Ļ�ѧ����ʽ��____________________________��
(3)Ϊ��ʹ��Ӧ��50��60 ���½��У����õķ�����__________��
(4)��ϴ�Ӳ����У��ڶ���ˮϴ��������____________________��
���𰸡���˿���ȿ죬������ʧ����Ҫ�����ᷴӦ H��(aq)��OH��(aq) =H2O(l)����H����56.8kJ/mol ��Һ©�� ����������ƽ����ѹ 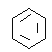 +HNO3
+HNO3![]()
 +H2O ˮԡ���� ϴȥ������NaOH�����ɵ���
+H2O ˮԡ���� ϴȥ������NaOH�����ɵ���
��������
I��(1)���ܽ����β����������Ϊͭ˿���������Ϊͭ˿��������ȵ������壬�������ȿ죬������ʧ�ࣻ
(2)�����ݴ���������к���Ϊ56.8 kJ��mol��1����ϡ������ϡ����������Һ��ȫ��Ӧ����1molˮʱ�ų�������Ϊ56.8 kJ��mol��1���кͷ�Ӧ��ʵ��Ϊ�����Ӻ����������ӷ�Ӧ����ˮ�����Ȼ�ѧ����ʽΪ��H��(aq)��OH��(aq) =H2O(l)����H����56.8kJ/mol��
II��(1)����ͼʾ��װ��B�������Ƿ�Һ©����װ��A�б���������ӷ���������ʧ���ܱ������»ᵼ��װ����ѹǿ����װ��CΪ�����ܣ�������������ƽ����ѹ���ã�
(2)ʵ�����ñ���Ũ������Ũ���ᡢ����������������������ˮ����Ӧ����ʽΪ�� +HNO3
+HNO3![]()
 +H2O��
+H2O��
(3)Ϊ��ʹ��Ӧ��50��60 ���½��У���Ӧ�¶ȵ���ˮ�ķе㣬���õķ�����ˮԡ���ȣ�
(4)��ϴ�Ӳ����У��ڶ���ˮϴ��������ϴȥ������NaOH�����ɵ��Ρ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
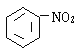
����Ŀ��ijͬѧ��ȡ9.00g��������ˮ���ⶨ���۵�ˮ��ٷ��ʣ���������£�
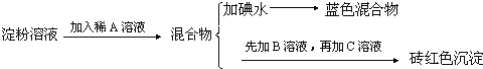
�Իش��������⣺
��1������������Լ�Ϊ��A_________��B_________��C_________��
��2������A��Һ��������B��Һ�Ƿ����_________����������_________��
��3��д������ˮ��ķ���ʽ_________��
��4��������1.44gש��ɫ����ʱ������ˮ������_________��[��֪��������Cu��OH��2��Ӧ�Ļ�ѧ����ʽΪ��CH2OH��CHOH��4CHO+2Cu��OH��2![]() CH2OH��CHOH��4COOH+Cu2O��+2H2O]��
CH2OH��CHOH��4COOH+Cu2O��+2H2O]��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������þ��ҽ���Ͼ��������εȹ�Ч������þ����Ҫ�ɷ���MgCO3��Ϊ��Ҫԭ���Ʊ�����þ�ķ������£�

��1���������з�����Ӧ�����ӷ���ʽΪ____________________________________��
��2���������е���pH=6.0~6.5��Ŀ����___________________________________��
��3���������IJ���Ϊ______________________________
��4����֪���ָʾ�����������ɫ��pH��Χ�����ʾ��
pH | < 8.0 | 8.0 ~ 9.6 | > 9.6 |
��ɫ | ��ɫ | ��ɫ | ��ɫ |
25��ʱ����Mg(OH)2�ı�����Һ�еμ�2�ΰ������ָʾ������Һ�����ֵ���ɫΪ_____[25��ʱ��Ksp[Mg(OH)2] =5.6��10-12]��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ijԪ�صļ����άͼ��AΪ���Σ�ͨ��������Z����ɫ��Һ��D����Է���������EС16��������ת����ϵ��ͼ��ʾ������˵������ȷ����
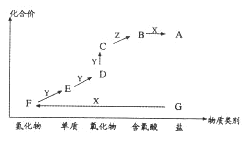
A.��X��һ��ǿ���FΪ����
B.��X��һ��ǿ�ᣬ��FΪ����
C.B��F��һ�������¾��ܷ�����Ӧ���Ҷ�����
D.B��һ�������¿�ֱ����Y��Ӧ����D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��I����1����ͨп�̸ɵ�صĽṹ��ͼ��ʾ���ش��������⡣

�ٵ���е������ҺΪ________��
�ڸ�����ӦʽΪ______________________________________��
�۷ŵ�ʱNH![]() ��________(��������������������)�ƶ���
��________(��������������������)�ƶ���
��2���ϵ���е�пƤ������ʵ��������������пƤ�ʹ�п���ֱ���ͬŨ�ȵ�ϡ���ᷴӦ�������������ʽϴ����________�����ù����Ĵ�п����һ������ϡ���ᷴӦ��Ϊ�˼ӿ췴Ӧ�����ֲ�Ӱ������������������д�ʩ���е���________(�����)��
A���� B��������������ͭ C��������������ͭ��Һ
D����ˮ E��������������������Һ
II��һ�������£�H2O2��ˮ��Һ�з����ֽⷴӦ��2H2O2![]() 2H2O��O2������Ӧ�����У���ò�ͬʱ��H2O2�����ʵ���Ũ�����±���
2H2O��O2������Ӧ�����У���ò�ͬʱ��H2O2�����ʵ���Ũ�����±���
t/min | 0 | 20 | 40 | 60 | 80 |
c(H2O2)/(mol/L) | 0.80 | 0.40 | 0.20 | 0.10 | 0.05 |
��1��H2O2�ķֽⷴӦ________������ԭ��Ӧ(������������������)��
��2���÷ֽⷴӦ0��20 min��ƽ����Ӧ����v(H2O2)Ϊ________ mol/(L��min)��
��3�� ����0.1 mol��MnO2��ĩ��50 mL�����������Һ��(�ܶ�Ϊ1.1 g/mL)���ڱ�״���·ų�����������ʱ��Ĺ�ϵ��ͼ��ʾ����Ӧ�ų�![]() ��������Ҫ��ʱ��Ϊ________��A��B��C��D�ĵ㻯ѧ��Ӧ���ʿ�����˳��Ϊ________��
��������Ҫ��ʱ��Ϊ________��A��B��C��D�ĵ㻯ѧ��Ӧ���ʿ�����˳��Ϊ________��

��4���ɺϳ���(���ΪH2��CO��������CO2)ֱ���Ʊ������ѣ�������Ҫ���̰��������ĸ���Ӧ��
�״��ϳɷ�Ӧ����CO(g)�� 2H2(g)=CH3OH(g) ��H1����90.1 kJ��mol��1
��CO2(g)�� 3H2(g)=CH3OH(g)��H2O(g) ��H2����49.0 kJ��mol��1
ˮú���任��Ӧ����CO(g) �� H2O (g)=CO2(g)��H2(g) ��H3����41.1 kJ��mol��1
�����Ѻϳɷ�Ӧ��
��H2��COֱ���Ʊ�������(��һ����Ϊˮ����)���Ȼ�ѧ����ʽΪ________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��A����Է�������Ϊ84���ش��������⣺
��1����A�ķ���ʽΪ__������������A�����������ϣ��������ʵ���һ�������ȼ���������������������_____����������һ�������ȼ���������������������_____��
A.C7H8 B.C6H14 C.C7H14 D.C8H8
��2������A���������е�̼ԭ����ͬһƽ���ϣ��Ҹ÷��ӵ�һ��ȡ����ֻ��һ�֡���A�Ľṹ��ʽΪ__����A����ʹ��ˮ��ɫ������һ�ȴ���ֻ��һ�֣���A�Ľṹ��ʽΪ__��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ˮ�Ǻϳ�ϩ���ij��÷�����ʵ���Һϳɻ���ϩ�ķ�Ӧ��ʵ��װ�����£�


�����õ����й��������£�
��Է������� | �ܶ�/��g��cm-3�� | �е�/�� | �ܽ��� | |
������ | 100 | 0.9618 | 161 | ����ˮ |
����ϩ | 82 | 0.8102 | 83 | ������ˮ |
�ϳɷ�Ӧ����a�м���20g��������2СƬ���Ƭ����ȴ��������������1mLŨH2SO4��b��ͨ����ȴˮ��ʼ��������a�������������¶Ȳ�����90�档
�����ᴿ����Ӧ�ֲ��ﵹ���Һ©���зֱ�������5%̼������Һ��ˮϴ�ӣ�����������ˮ�Ȼ��ƿ���������һ��ʱ�����ȥ�Ȼ��ƣ�����ͨ������õ���������ϩ10g���ش��������⣺
��1��װ��b��������__��
��2������һ��ʱ��������ǼӴ�Ƭ��Ӧ�ò�ȡ����ȷ������__��
A.�������� B.��ȴ�� C.���貹�� D.��������
��3����ʵ���������ײ����ĸ�����Ľṹ��ʽΪ__��
��4�������ᴿ�����м�����ˮ�Ȼ��Ƶ�Ŀ����__��
��5����ʵ�����õ��Ļ���ϩ������__������ȷ�𰸱�ţ���
A.41% B.50% C.61% D.70%
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���1 L 0.1 mol��L��1һԪ��HR��Һ����ͨ�백������֪������NH3��H2O����ƽ�ⳣ��K��1.76��10��5�ݣ�ʹ��Һ�¶Ⱥ�������ֲ��䣬�����Һ��pH������Ũ�ȱ仯�Ĺ�ϵ����ͼ��ʾ������������ȷ����

A. 0.1 mol��L��1 HR��Һ��pHΪ5
B. HRΪ���ᣬ����ʱ���Ű�����ͨ�룬c(R��)/[c(OH��).c(HR)] ������
C. ��ͨ��0.1 mol NH3ʱ��c(NH4+)��c(R��)��c(OH��)��c(H+)
D. ��c(R��)�� c(HR)ʱ����Һ��Ϊ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijͬѧ����Ӱ�������Һ��������������Һ��Ӧ�������ص��о��������£�ʵ���������£�
ʵ����� | �� | �� | �� |
�����Լ� | 4mL 0.01mol/L KMnO4 2mL 0.1mol/L H2C2O4 | 4mL 0.01mol/L KMnO4 2mL 0.1mol/L H2C2O4 ����MnSO4���� | 4mL 0.01mol/L KMnO4 2mL 0.1mol/L H2C2O4 ����Na2SO4���� |
��ɫʱ��/s | 116 | 6 | 117 |
��1��������Һ��������������Һ��Ӧ�����ӷ���ʽΪ___________________��
��2����ʵ�������_______________________��
��3��������������ʵ���ͬѧ���з�˼����Ϊʵ��ٵ��������֤���������ۡ���д��ʵ��ٵ�����Ϊ____________________��
��4��ʵ���ѡ��MnSO4���������MnCl2�����ԭ����_________________��
��5����ͬѧ���������ͼ��ʾ��ʵ�鷽������̽����������Է�Ӧ���ʵ�Ӱ�졣

a����ͬѧ���о���Ӱ��������___________________��
b������Ϊ��ͬѧ��ʵ�鷽��_______________���������������������������____________________________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com