
【题目】硫酸镁在医疗上具有镇静、抗挛等功效。以菱镁矿(主要成分是MgCO3)为主要原料制备硫酸镁的方法如下:

(1)步骤②中发生反应的离子方程式为____________________________________。
(2)步骤④中调节pH=6.0~6.5的目的是___________________________________。
(3)步骤⑤的操作为______________________________
(4)已知酸碱指示剂百里酚蓝变色的pH范围如表所示:
pH | < 8.0 | 8.0 ~ 9.6 | > 9.6 |
颜色 | 黄色 | 绿色 | 蓝色 |
25℃时,向Mg(OH)2的饱和溶液中滴加2滴百里酚蓝指示剂,溶液所呈现的颜色为_____[25℃时,Ksp[Mg(OH)2] =5.6×10-12]。
【答案】2NH4++ MgO=Mg2++ 2NH3↑+ H2O 抑制Mg2+水解,以便得到更多更纯的产品 蒸发浓缩,冷却结晶 蓝色
【解析】
(1)MgO与硫酸铵溶液加热反应生成的气体与硫酸反应生成硫酸铵,说明该气体是氨气,则MgO与硫酸铵加热的产物中有氨气,说明MgO的加入,促进铵根离子的水解,生成氨气,得到的氢离子与MgO反应生成镁离子和水,所以步骤②中发生反应的离子方程式为2NH4++ MgO=Mg2++ 2NH3↑+ H2O;
(2)得到的硫酸镁溶液中镁离子水解,得不到较纯的硫酸镁晶体所以为抑制镁离子水解,步骤④中调节pH=6.0~6.5,以便得到更多更纯的产品;
(3)由溶液得到晶体需进行的操作是蒸发浓缩、冷却结晶,所以步骤⑤的操作为蒸发浓缩,冷却结晶;
(4)饱和的氢氧化镁溶液存在Mg(OH)2 (s)= Mg2+(aq) + 2 OH-(aq)溶解平衡,2c(Mg2+)= c(OH -),又溶度积Ksp= c(Mg2+)c2(OH -)=5.6×10-12 ,由此可以得出c(OH -)=2.24×10-4 ,c(H+)=1×10-14/2.24×10-4 =4.5×10-11,所以pH>9.6,所以加入百里酚蓝指示剂,溶液呈蓝色。


 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案 初中暑期衔接系列答案
初中暑期衔接系列答案科目:高中化学 来源: 题型:
【题目】近段时间,全国范围内的雾霾天气严重影响了人们的身体健康,环境问题越来越受到人们的重视。处理大气中的污染物,打响“蓝天白云”保卫战是当前的重要课题。请回答下列问题:
(1)汽车尾气中含有较多的NOx和CO,两种气体均会使人体中毒。可以利用如下化学方法将其转化为无毒无害的物质。
已知:N2(g)+O2(g)2NO(g) ΔH=+180 kJ·mol-1
2CO(g)+O2(g)2CO2(g) ΔH=-564 kJ·mol-1
请写出把汽车尾气转化为无毒无害的物质的热化学方程式: _________
(2)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g)CH3OH(g)。在密闭容器中充有2mol CO和4molH2,在催化剂作用下发生反应生成甲醇,改变条件,测得CO的平衡转化率与温度(T)、压强(p)的关系如图所示。则该反应为______反应(填“吸热”或“放热”)。若达到平衡状态A时,容器的体积为2L,则在平衡状态B时容器的体积为_______2L(填“>”、“=”或“<”)。该反应T2温度下,若反应进行到1 min达到平衡状态,用CO的分压变化表示的平均反应速率vp(CO)=_______ kPa·min-1,此时的化学平衡常数Kp=_____(Kp是以分压表示的平衡常数,某气体的分压=气体总压强×该气体的体积分数(或物质的量分数))。

(3)工业上可采用CH3OHCO+2H2的方法来制取高纯度的CO和H2。我国学者采用量子力学方法,通过计算机模拟,研究了在钯基催化剂表面上甲醇制氢的反应历程,其中吸附在钯催化剂表面上的物种用*标注。甲醇(CH3OH)脱氢反应的第一步历程,有两种可能方式:
方式 A:CH3OH* →CH3O* +H* Ea= +103.1kJ·mol-1
方式 B:CH3OH* →CH3* +OH* Eb= +249.3kJ·mol-1
由活化能E值推测,甲醇裂解过程主要历经的方式应为______ (填A、B)。
(4)如图为计算机模拟的各步反应的能量变化示意图。

该历程中,放热最多的步骤的化学方程式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汉黄芩素是传统中草药黄芩的有效成分之一,对肿瘤细胞的杀伤有独特作用。下列有 关汉黄芩素的叙述正确的是
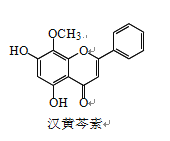
A. 汉黄芩素的分子式为 C16H13O5
B. 该物质遇 FeCl3 溶液显色
C. 1 mol 该物质与溴水反应,最多消耗 1 mol Br2
D. 与足量 H2 发生加成反应后,该分子中官能团的种类减少 1 种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为药用有机物,存在如图所示的转化关系。已知A在一定条件下能跟醇发生酯化反应,A分子中苯环上的两个取代基处于邻位,D能跟NaOH溶液反应。
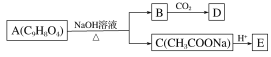
请回答:
(1)A转化为B、C时,涉及的反应类型有____________________________________、_______________。
(2)E的两种同分异构体Q、R都能在一定条件下发生银镜反应,R能与Na反应放出H2,而Q不能。Q、R的结构简式为Q________________;R________________。
(3)D的结构简式为____________。
(4)写出A在加热条件下与NaOH溶液反应的化学方程式:______________________。
(5)已知:![]()
![]()
 请选用适当物质设计一种合成方法。用邻甲基苯酚经两步反应合成有机物A,在方框中填写有机物的结构简式。
请选用适当物质设计一种合成方法。用邻甲基苯酚经两步反应合成有机物A,在方框中填写有机物的结构简式。![]()
![]()
![]()
![]() 有机物A。
有机物A。
___________; ____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是关于硫化氢的部分文献资料
资料:常温常压下,硫化氢(H2S)是一种无色气体,具有臭鸡蛋气味,饱和硫化氢溶液的物质的量浓度约为0.1mol·L-1。硫化氢剧毒,经粘膜吸收后危害中枢神经系统和呼吸系统,对心脏等多种器官造成损害。硫化氢的水溶液称氢硫酸(弱酸),长期存放会变浑浊。硫化氢及氢硫酸发生的反应主要有:
2H2S+O2=2H2O+2S 2H2S+3O2=2H2O+2SO2
2H2S+SO2=2H2O+3S 2H2S+Cl2=2HCl+S↓
H2S=H2+S H2S+CuSO4=CuS↓+H2SO4
H2S+2NaOH=Na2S+2H2O H2S+NaOH=NaHS+H2O
……
某研究性学习小组对资料中“氢硫酸长期存放会变浑浊”这一记载十分感兴趣,为了探究其原因,他们分别做了如下实验:
实验一:将H2S气体溶于蒸馏水制成氢硫酸饱和溶液,在空气中放置1~2天未见浑浊现象。用相同浓度的碘水去滴定氢硫酸溶液测其浓度。图一所示为两只烧杯中氢硫酸浓度随时间变化而减小的情况。
实验二:密闭存放的氢硫酸,每天定时取1mL氢硫酸,用相同浓度的碘水滴定,图二所示为氢硫酸浓度随放置天数变化的情况。

实验三:在饱和氢硫酸溶液中以极慢的速度通入空气(1~2个气泡/min),数小时未见变浑浊的现象。

实验四:盛满试剂瓶,密闭存放的饱和氢硫酸溶液隔2~3天观察,直到略显浑浊;当把满瓶的氢硫酸倒扣在培养皿中观察2~3天,在溶液略显浑浊的同时,瓶底仅聚集有少量的气泡,随着时间的增加,这种气泡也略有增多(大),浑浊现象更明显些。请回答下列问题:

(1)实验一(见图一)中,氢硫酸的浓度随时间变化而减小的主要因素是_______________。
(2)实验一和实验二中,碘水与氢硫酸反应的化学方程式为_________________________。两个实验中准确判断碘水与氢硫酸恰好完全反应是实验成功的关键。请设计实验方案,使实验者准确掌握所加碘水恰好与氢硫酸完全反应___________________________________________________________________________。
(3)“氢硫酸长期存放会变浑浊”中,出现浑浊现象是由于生成了_____________的缘故。
(4)该研究性学习小组设计实验三,说明他们认为“氢硫酸长期存放会变浑浊”的假设原因之一是(用文字说明)__________________________________。此实验中通入空气的速度很慢的主要原因是什么?________________________________________________________。
(5)实验四的实验现象说明“氢硫酸长期存放会变浑浊”的主要原因可能是__________。为进一步证实上述原因的准确性,你认为还应做哪些实验(只需用文字说明实验设想,不需要回答实际步骤和设计实验方案)?_____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是元素周期表的一部分,其中X、Y、Z均为短周期元素,它们的位置关系如图所示,已知三种元素的质子数之和为31,写出:
X | ||
Y | Z |
(1)写出X、Y、Z的元素符号:___、___、___。
(2)写出Y元素的离子结构示意图:___。
(3)元素Y和Z的金属性较强的是___(填元素符号)。
(4)Z是大自然赐予人类的宝物。它其中的一个用途是和氧化铁反应制得难熔金属铁,该反应的化学方程式为___,Z表现出的性质是___(氧化性/还原性),反应时可观察到的实验现象有___(填字母)。
A.产生红棕色烟雾 B.发出耀眼的光芒 C.有熔融物生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验能达到实验目的的是( )
序号 | 实验内容 | 实验目的 |
A | 盛有 | 探究浓度对反应速率的影响 |
B | 向3 mL KI溶液中滴加几滴溴水,振荡,再滴加1mL淀粉溶液,溶液显蓝色 | 比较Br2 和I2的氧化性强弱 |
C | 在容积可变的密闭容器中发生反应:2NO2(g) | 正反应速率加快,逆反应速率减慢 |
D | 向2支试管中各加入相同体积、相同浓度的 | 探究温度对反应速率的影响 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I、实验室用50 mL 0.50 mol·L-1盐酸、50 mL 0.55 mol·L-1 NaOH溶液和如图所示装置,进行测定中和热的实验,得到表中的数据:完成下列问题:
实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | |
盐酸 | NaOH溶液 | ||
1 | 20.2 | 20.3 | 23.7 |
2 | 20.3 | 20.5 | 23.8 |
3 | 21.5 | 21.6 | 24.9 |

(1)不能用铁丝搅拌棒代替环形玻璃搅拌棒的理由是_______
(2)经数据处理,测得中和热为56.8 kJ·mol-1其热化学方程式为:___________
II.实验室制备硝基苯实验装置和步骤如下:(实验步骤)

取100 mL烧杯,用20 mL浓硫酸与18 mL浓硝酸配制混合液,将混合酸小心加入B中,把18 mL(15.84 g)苯加入A中。向室温下的苯中逐滴加入混酸,边滴边搅拌,混合均匀,在50~60℃下发生反应,直至反应结束。
将反应液冷却至室温后倒入分液漏斗中,依次用少量水、5% NaOH溶液和水洗涤。分出的产物加入无水CaCl2颗粒,静置片刻,弃去CaCl2,进行蒸馏纯化,收集205~210 ℃馏分,得到纯硝基苯18.00 g。请回答:
(1)装置B的名称是________,装置C的作用是________________。
(2)实验室制备硝基苯的化学方程式是____________________________。
(3)为了使反应在50~60 ℃下进行,常用的方法是__________。
(4)在洗涤操作中,第二次水洗的作用是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】PET(聚对二苯甲酸乙二醇酯)是制备医用防护服的重要材料。以石油作为原料合成PET中间体的流程如图:
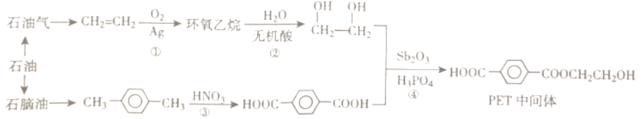
(1)环氧乙烷的分子式为C2H4O,分子中存在一个环状结构。环氧乙烷的结构简式为___,环氧乙烷有多种同分异构体,下列结构与环氧乙烷互为同分异构体的是___ (填代号)
a.CH3CHO b.HOCH2CH2OOH c.CH2=CHOH
(2)反应②的产物是乙二醇。乙二醇属于醇类化合物,性质与乙醇类似。乙二醇的官能团是___。(填名称或者结构简式)
(3)从石脑油中可以提炼出对二甲苯(![]() )。对二甲苯的分子式为___。对二甲苯在浓硫酸和浓硝酸存在的条件下,可以在苯环上形成硝基取代产物(分子式为C8H8N2O4),该硝基取代产物的所有可能的结构简式为___。
)。对二甲苯的分子式为___。对二甲苯在浓硫酸和浓硝酸存在的条件下,可以在苯环上形成硝基取代产物(分子式为C8H8N2O4),该硝基取代产物的所有可能的结构简式为___。
(4)反应④的化学方程式为___。该反应的反应类型为___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com