
【题目】下面是关于硫化氢的部分文献资料
资料:常温常压下,硫化氢(H2S)是一种无色气体,具有臭鸡蛋气味,饱和硫化氢溶液的物质的量浓度约为0.1mol·L-1。硫化氢剧毒,经粘膜吸收后危害中枢神经系统和呼吸系统,对心脏等多种器官造成损害。硫化氢的水溶液称氢硫酸(弱酸),长期存放会变浑浊。硫化氢及氢硫酸发生的反应主要有:
2H2S+O2=2H2O+2S 2H2S+3O2=2H2O+2SO2
2H2S+SO2=2H2O+3S 2H2S+Cl2=2HCl+S↓
H2S=H2+S H2S+CuSO4=CuS↓+H2SO4
H2S+2NaOH=Na2S+2H2O H2S+NaOH=NaHS+H2O
……
某研究性学习小组对资料中“氢硫酸长期存放会变浑浊”这一记载十分感兴趣,为了探究其原因,他们分别做了如下实验:
实验一:将H2S气体溶于蒸馏水制成氢硫酸饱和溶液,在空气中放置1~2天未见浑浊现象。用相同浓度的碘水去滴定氢硫酸溶液测其浓度。图一所示为两只烧杯中氢硫酸浓度随时间变化而减小的情况。
实验二:密闭存放的氢硫酸,每天定时取1mL氢硫酸,用相同浓度的碘水滴定,图二所示为氢硫酸浓度随放置天数变化的情况。

实验三:在饱和氢硫酸溶液中以极慢的速度通入空气(1~2个气泡/min),数小时未见变浑浊的现象。

实验四:盛满试剂瓶,密闭存放的饱和氢硫酸溶液隔2~3天观察,直到略显浑浊;当把满瓶的氢硫酸倒扣在培养皿中观察2~3天,在溶液略显浑浊的同时,瓶底仅聚集有少量的气泡,随着时间的增加,这种气泡也略有增多(大),浑浊现象更明显些。请回答下列问题:

(1)实验一(见图一)中,氢硫酸的浓度随时间变化而减小的主要因素是_______________。
(2)实验一和实验二中,碘水与氢硫酸反应的化学方程式为_________________________。两个实验中准确判断碘水与氢硫酸恰好完全反应是实验成功的关键。请设计实验方案,使实验者准确掌握所加碘水恰好与氢硫酸完全反应___________________________________________________________________________。
(3)“氢硫酸长期存放会变浑浊”中,出现浑浊现象是由于生成了_____________的缘故。
(4)该研究性学习小组设计实验三,说明他们认为“氢硫酸长期存放会变浑浊”的假设原因之一是(用文字说明)__________________________________。此实验中通入空气的速度很慢的主要原因是什么?________________________________________________________。
(5)实验四的实验现象说明“氢硫酸长期存放会变浑浊”的主要原因可能是__________。为进一步证实上述原因的准确性,你认为还应做哪些实验(只需用文字说明实验设想,不需要回答实际步骤和设计实验方案)?_____________________________________。
【答案】硫化氢的挥发 H2S+I2=2HI+S↓ 向氢硫酸中加入淀粉液,滴加碘水到溶液刚好呈蓝色 S或硫 氢硫酸被空气中氧气氧化 防止因通入空气过快而使硫化氢大量挥发 硫化氢自身分解 确证生成的气体是氢气
【解析】
(1)因为硫化氢气体溶于水生成氢硫酸,所以氢硫酸具有一定的挥发性,且能被空气中的氧气氧化而生成硫。实验一(见图一)中,溶液未见浑浊,说明浓度的减小不是由被氧化引起的。
(2)实验一和实验二中,碘水与氢硫酸发生置换反应,生成硫和水。使实验者准确掌握所加碘水恰好与氢硫酸完全反应,应使用指示剂。
(3)“氢硫酸长期存放会变浑浊”中,出现的浑浊只能为硫引起。
(4)实验三中,氢硫酸溶液与空气接触,则是硫化氢与空气中氧气反应所致。此实验中通入空气的速度很慢,主要从硫化氢的挥发性考虑。
(5)实验四为密闭容器,与空气接触很少,所以应考虑分解。因为被氧化时,生成硫和水;分解时,生成硫和氢气,所以只需检验氢气的存在。
(1)实验一(见图一)中,溶液未见浑浊,说明浓度的减小不是由被氧化引起,应由硫化氢的挥发引起。答案为:硫化氢的挥发;
(2)实验一和实验二中,碘水与氢硫酸发生置换反应,方程式为H2S+I2=2HI+S↓。实验者要想准确掌握所加碘水恰好与氢硫酸完全反应,应使用淀粉作指示剂,即向氢硫酸中加入淀粉液,滴加碘水到溶液刚好呈蓝色。答案为:H2S+I2=2HI+S↓;向氢硫酸中加入淀粉液,滴加碘水到溶液刚好呈蓝色;
(3)“氢硫酸长期存放会变浑浊”中,不管是氧化还是分解,出现的浑浊都只能为硫引起。答案为:S或硫;
(4)实验三中,氢硫酸溶液与空气接触,则是硫化氢与空气中氧气反应所致。此实验中通入空气的速度很慢,防止因通入空气过快而使硫化氢大量挥发。答案为:氢硫酸被空气中氧气氧化;防止因通入空气过快而使硫化氢大量挥发;
(5)实验四为密闭容器,与空气接触很少,所以应考虑硫化氢自身分解。因为被氧化时,生成硫和水;分解时,生成硫和氢气,所以只需检验氢气的存在。答案为:硫化氢自身分解;确证生成的气体是氢气。


 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案科目:高中化学 来源: 题型:
【题目】实验室用燃烧法测定某种氨基酸(CxHyOzNm)的分子组成。取Wg该种氨基酸放在纯氧中充分燃烧,生成二氧化碳、水和氮气。按下图所示装置进行实验。

回答下列问题:
(1)实验开始时,首先通入一段时间的氧气,其理由是__________________。
(2)以上装置中需要加热的仪器有_______ (填写字母),操作时应先点燃_____处的酒精灯。
(3)A装置中发生反应的化学方程式是____________________________。
(4)D装置的作用是____________________________。
(5)读取氮气的体积时,应注意①_________________;②_________________。
(6)实验中测得氮气的体积为VmL(标准状况),为确定此氨基酸的分子式,还需要的有关数据有____________________。
A.生成二氧化碳气体的质量
B.生成水的质量
C.通人氧气的体积
D.氨基酸的相对分子质量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】100g碳燃烧所得气体中,CO占![]() ,CO2占
,CO2占![]() 体积,且C(s)+
体积,且C(s)+![]() O2(g)===CO(g);ΔH(298K)=-110.35kJ·mol-1,CO(g)+
O2(g)===CO(g);ΔH(298K)=-110.35kJ·mol-1,CO(g)+![]() O2(g)===CO2(g);ΔH(298K)=-282.57kJ·mol-1。与这些碳完全燃烧相比较,损失的热量是( )
O2(g)===CO2(g);ΔH(298K)=-282.57kJ·mol-1。与这些碳完全燃烧相比较,损失的热量是( )
A.392.92kJ B.2489.44kJ
C.784.92kJ D.3274.3kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】-定条件下,各微粒有如下变化(示意图如下),其中![]() 和O代表短周期前10号不同元素的原子。反应物
和O代表短周期前10号不同元素的原子。反应物![]() 为液体,生成物均为气体。
为液体,生成物均为气体。
![]()
下列有关判断错误的是
A.反应物![]() 的名称是乙烯
的名称是乙烯
B.上述反应的氧化产物为![]()
C.反应前后,一定是共价键的断裂与生成
D.上述反应方程式,物质之间没有确定的系数比
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:通常羟基与碳碳双键相连时不稳定,易发生下列变化:
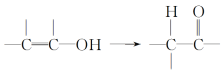
依据如下图所示的转化关系,回答问题:
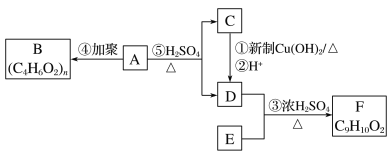
(1)A的化学式是______________________________________________________,官能团是酯基和______________(填名称)。
(2)①的化学方程式是__________________________________________________。
(3)F是芳香族化合物且苯环上只有一个侧链,③的化学方程式是________________________________。
(4)绿色化学中,最理想的“原子经济”是原子利用率100%,上述反应中能体现“原子经济”原则的是______________(填字母)。
a.① b.③ c.④
(5)G是F的同分异构体,有关G的描述:
①能发生水解 ②苯环上有三个取代基 ③苯环上一溴代物有2种
据此推测G的结构简式可能是(写出其中一种)___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸镁在医疗上具有镇静、抗挛等功效。以菱镁矿(主要成分是MgCO3)为主要原料制备硫酸镁的方法如下:

(1)步骤②中发生反应的离子方程式为____________________________________。
(2)步骤④中调节pH=6.0~6.5的目的是___________________________________。
(3)步骤⑤的操作为______________________________
(4)已知酸碱指示剂百里酚蓝变色的pH范围如表所示:
pH | < 8.0 | 8.0 ~ 9.6 | > 9.6 |
颜色 | 黄色 | 绿色 | 蓝色 |
25℃时,向Mg(OH)2的饱和溶液中滴加2滴百里酚蓝指示剂,溶液所呈现的颜色为_____[25℃时,Ksp[Mg(OH)2] =5.6×10-12]。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I、(1)普通锌锰干电池的结构如图所示。回答下列问题。

①电池中电解质溶液为________。
②负极反应式为______________________________________。
③放电时NH![]() 向________(填“正极”或“负极”)移动。
向________(填“正极”或“负极”)移动。
(2)废电池中的锌皮常用于实验室制氢气,废锌皮和纯锌粒分别与同浓度的稀硫酸反应,产生氢气速率较大的是________,若用过量的纯锌粒与一定量的稀硫酸反应,为了加快反应速率又不影响产生氢气的量,下列措施可行的是________(填序号)。
A.微热 B.加入适量氧化铜 C.加入少量硫酸铜溶液
D.加水 E.加入少量氢氧化钡溶液
II、一定条件下,H2O2在水溶液中发生分解反应:2H2O2![]() 2H2O+O2↑,反应过程中,测得不同时间H2O2的物质的量浓度如下表:
2H2O+O2↑,反应过程中,测得不同时间H2O2的物质的量浓度如下表:
t/min | 0 | 20 | 40 | 60 | 80 |
c(H2O2)/(mol/L) | 0.80 | 0.40 | 0.20 | 0.10 | 0.05 |
(1)H2O2的分解反应________氧化还原反应(填“是”或“不是”)。
(2)该分解反应0~20 min的平均反应速率v(H2O2)为________ mol/(L·min)。
(3) 加入0.1 mol的MnO2粉末于50 mL过氧化氢的溶液中(密度为1.1 g/mL),在标准状况下放出气体的体积和时间的关系如图所示,反应放出![]() 气体所需要的时间为________;A、B、C、D四点化学反应速率快慢的顺序为________。
气体所需要的时间为________;A、B、C、D四点化学反应速率快慢的顺序为________。

(4)由合成气(组成为H2、CO、和少量CO2)直接制备二甲醚,其中主要过程包括以下四个反应:
甲醇合成反应:①CO(g)+ 2H2(g)=CH3OH(g) ΔH1=-90.1 kJ·mol-1
②CO2(g)+ 3H2(g)=CH3OH(g)+H2O(g) ΔH2=-49.0 kJ·mol-1
水煤气变换反应:③CO(g) + H2O (g)=CO2(g)+H2(g) ΔH3=-41.1 kJ·mol-1
二甲醚合成反应:
由H2和CO直接制备二甲醚(另一产物为水蒸气)的热化学方程式为________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,在20mL0.lmol/LNa2CO3溶液中逐滴加入40mL0.l mol/L 稀盐酸,溶液中含碳元素各种微粒(CO2因逸出未画出)的物质的量分数(纵轴)随溶液pH变化的部分情况如图所示。下列说法正确的是

A.曲线a表示H2CO3的变化曲线
B.H2CO3、HCO3-、CO32-可大量共存于同一溶液中
C.pH=11时,c(HCO3-)>c(Cl-)
D.碳酸钠溶液的水解平衡常数为1.0×10-11
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com