
【题目】醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如下:


可能用到的有关数据如下:
相对分子质量 | 密度/(g·cm-3) | 沸点/℃ | 溶解性 | |
环己醇 | 100 | 0.9618 | 161 | 微溶于水 |
环己烯 | 82 | 0.8102 | 83 | 难溶于水 |
合成反应:在a中加入20g环己醇和2小片碎瓷片,冷却搅动下慢慢加入1mL浓H2SO4,b中通入冷却水后,开始缓慢加热a,控制馏出物的温度不超过90℃。
分离提纯:反应粗产物倒入分液漏斗中分别用少量5%碳酸钠溶液和水洗涤,分离后加入无水氯化钙颗粒,静置一段时间后弃去氯化钙,最终通过蒸馏得到纯净环己烯10g。回答下列问题:
(1)装置b的名称是__。
(2)加热一段时间后发现忘记加瓷片,应该采取的正确操作是__。
A.立即补加 B.冷却后补加 C.不需补加 D.重新配料
(3)本实验中最容易产生的副产物的结构简式为__。
(4)分离提纯过程中加入无水氯化钙的目的是__。
(5)本实验所得到的环己烯产率是__(填正确答案标号)。
A.41% B.50% C.61% D.70%
【答案】直形冷凝管 B ![]() 干燥(或除水除醇) C
干燥(或除水除醇) C
【解析】
环己醇在浓硫酸作催化剂的作用下发生消去反应生成环己烯,环己烯和环己醇的沸点较大,通过蒸馏,得到环己烯的粗品,后经分离提纯最终得到环己烯产品。
(1)装置b的名称是直形冷凝管;
(2)混合液态在加热时易发生暴沸现象,碎瓷片的存在可以防止在加热过程中产生暴沸现象;如果加热一段时间后发现忘记加瓷片,补加碎瓷片时需要待已加热的试液冷却后再加入,则B正确;
(3)醇在浓硫酸的作用下,也可以发生分子间的脱水,生成醚,该实验中最容易生成的副产物为![]() ;
;
(4)无水氯化钙具有吸水性,分离提纯过程中加入无水氯化钙可吸收产物中少量的水,干燥产品;
(5)20g的环己醇,其物质的量为0.2mol,则理论上含生成环己烯的质量为0.2mol×82g·mol-1=16.4g,实验得到环己烯10g,则其产率为![]() ,答案选C。
,答案选C。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】汉黄芩素是传统中草药黄芩的有效成分之一,对肿瘤细胞的杀伤有独特作用。下列有 关汉黄芩素的叙述正确的是

A. 汉黄芩素的分子式为 C16H13O5
B. 该物质遇 FeCl3 溶液显色
C. 1 mol 该物质与溴水反应,最多消耗 1 mol Br2
D. 与足量 H2 发生加成反应后,该分子中官能团的种类减少 1 种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验能达到实验目的的是( )
序号 | 实验内容 | 实验目的 |
A | 盛有 | 探究浓度对反应速率的影响 |
B | 向3 mL KI溶液中滴加几滴溴水,振荡,再滴加1mL淀粉溶液,溶液显蓝色 | 比较Br2 和I2的氧化性强弱 |
C | 在容积可变的密闭容器中发生反应:2NO2(g) | 正反应速率加快,逆反应速率减慢 |
D | 向2支试管中各加入相同体积、相同浓度的 | 探究温度对反应速率的影响 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I、实验室用50 mL 0.50 mol·L-1盐酸、50 mL 0.55 mol·L-1 NaOH溶液和如图所示装置,进行测定中和热的实验,得到表中的数据:完成下列问题:
实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | |
盐酸 | NaOH溶液 | ||
1 | 20.2 | 20.3 | 23.7 |
2 | 20.3 | 20.5 | 23.8 |
3 | 21.5 | 21.6 | 24.9 |

(1)不能用铁丝搅拌棒代替环形玻璃搅拌棒的理由是_______
(2)经数据处理,测得中和热为56.8 kJ·mol-1其热化学方程式为:___________
II.实验室制备硝基苯实验装置和步骤如下:(实验步骤)

取100 mL烧杯,用20 mL浓硫酸与18 mL浓硝酸配制混合液,将混合酸小心加入B中,把18 mL(15.84 g)苯加入A中。向室温下的苯中逐滴加入混酸,边滴边搅拌,混合均匀,在50~60℃下发生反应,直至反应结束。
将反应液冷却至室温后倒入分液漏斗中,依次用少量水、5% NaOH溶液和水洗涤。分出的产物加入无水CaCl2颗粒,静置片刻,弃去CaCl2,进行蒸馏纯化,收集205~210 ℃馏分,得到纯硝基苯18.00 g。请回答:
(1)装置B的名称是________,装置C的作用是________________。
(2)实验室制备硝基苯的化学方程式是____________________________。
(3)为了使反应在50~60 ℃下进行,常用的方法是__________。
(4)在洗涤操作中,第二次水洗的作用是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】石墨烯具有优异的光、电和力学特征。将石墨的单层结构剥离即能获得石墨烯。其结构如图所示,下列有关说法不正确的是( )

A.石墨烯具有优异的导电性能
B.石墨烯是由碳元素构成的一种单质
C.石墨烯中原子通过分子间作用力结合
D.石墨烯是一种二维单层结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将mg铜粉和锌粉的混合物分成两等份,将其中一份加入200mL的稀硝酸中并加热,固体和硝酸恰好完全反应,并产生标准状况下的NO2.24L(标准状况下);将另一份在空气中充分加热,的到n g固体,将所得固体溶于上述稀硝酸,消耗硝酸的体积为V ml。下列说法不正确的是
A.V=150Ml
B.硝酸的浓度为2 mol·L-1
C.m g铜粉和锌粉的物质的量之和为0.3 mol
D.n=m+2.4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是0.01 mol/L甲溶液滴定0.01 mol/L乙溶液的导电能力变化曲线,其中曲线③是盐酸滴定NaAc溶液,其他曲线是醋酸滴定NaOH溶液或者NaOH溶液滴定盐酸。下列判断错误的是
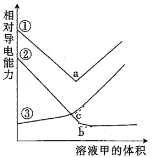
A.条件相同时导电能力:盐酸>NaAc
B.曲线①是NaOH溶液滴定盐酸导电能力变化曲线
C.随着甲溶液体积增大,曲线①仍然保持最高导电能力
D.a点是反应终点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】PET(聚对二苯甲酸乙二醇酯)是制备医用防护服的重要材料。以石油作为原料合成PET中间体的流程如图:
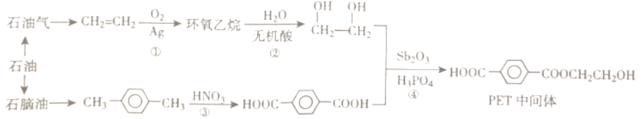
(1)环氧乙烷的分子式为C2H4O,分子中存在一个环状结构。环氧乙烷的结构简式为___,环氧乙烷有多种同分异构体,下列结构与环氧乙烷互为同分异构体的是___ (填代号)
a.CH3CHO b.HOCH2CH2OOH c.CH2=CHOH
(2)反应②的产物是乙二醇。乙二醇属于醇类化合物,性质与乙醇类似。乙二醇的官能团是___。(填名称或者结构简式)
(3)从石脑油中可以提炼出对二甲苯(![]() )。对二甲苯的分子式为___。对二甲苯在浓硫酸和浓硝酸存在的条件下,可以在苯环上形成硝基取代产物(分子式为C8H8N2O4),该硝基取代产物的所有可能的结构简式为___。
)。对二甲苯的分子式为___。对二甲苯在浓硫酸和浓硝酸存在的条件下,可以在苯环上形成硝基取代产物(分子式为C8H8N2O4),该硝基取代产物的所有可能的结构简式为___。
(4)反应④的化学方程式为___。该反应的反应类型为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着科技的进步,合理利用资源、保护环境成为当今社会关注的焦点。甲胺铅碘(CH3NH3PbI3)用作全固态钙钛矿敏化太阳能电池的敏化剂,可由CH3NH2、PbI2及HI为原料合成,制取甲胺的反应为CH3OH(g)+NH3(g)![]() CH3NH2(g)+H2O(g) ΔH。回答下列问题:
CH3NH2(g)+H2O(g) ΔH。回答下列问题:
(1)上述反应中所需的甲醇工业上利用水煤气合成,已知
①CO(g)+![]() O2(g)═CO2(g) △H1=-284kJ/mol
O2(g)═CO2(g) △H1=-284kJ/mol
②H2(g)+![]() O2(g)═H2O(g) △H2=-248kJ/mol
O2(g)═H2O(g) △H2=-248kJ/mol
③CH3OH(g)+![]() O2(g)═CO2(g)+2H2O(g) △H3=-651kJ/mol
O2(g)═CO2(g)+2H2O(g) △H3=-651kJ/mol
CO(g)+2H2(g)![]() CH3OH(g)ΔH=___。
CH3OH(g)ΔH=___。
(2)在一定条件下,将1molCO和2molH2通入密闭容器中进行反应,当改变某一外界条件(温度或压强)时,CH3OH的体积分数φ(CH3OH)变化趋势如图所示:
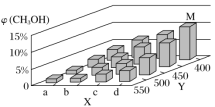
①平衡时,M点CH3OH的体积分数为10%,则CO的转化率为____。
②X轴上b点的数值比a点___(填“大”或“小”)。某同学认为图中Y轴表示温度,你认为他判断的理由是___。
(3)实验室可由四氧化三铅和氢碘酸反应制备难溶的PbI2,常温下,PbI2饱和溶液(呈黄色)中c(Pb2+)=1.0×10-3mol·L-1,则Ksp(PbI2)=___;已知Ksp(PbCl2)=1.6×10-5,则转化反应PbI2(s)+2Cl-(aq)![]() PbCl2(s)+2I-(aq)的平衡常数K=___。
PbCl2(s)+2I-(aq)的平衡常数K=___。
(4)分解HI曲线和液相法制备HI反应曲线分别如图1和图2所示:
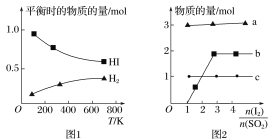
①反应H2(g)+I2(g)![]() 2HI(g)的ΔH__(填大于或小于)0。
2HI(g)的ΔH__(填大于或小于)0。
②将二氧化硫通入碘水中会发生反应:SO2+I2+2H2O![]() 3H++HSO4-+2I-,I2+I-
3H++HSO4-+2I-,I2+I-![]() I3-,图2中曲线a、b分别代表的微粒是___、___(填微粒符号);由图2知要提高碘的还原率,除控制温度外,还可以采取的措施是___。
I3-,图2中曲线a、b分别代表的微粒是___、___(填微粒符号);由图2知要提高碘的还原率,除控制温度外,还可以采取的措施是___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com