
【题目】将mg铜粉和锌粉的混合物分成两等份,将其中一份加入200mL的稀硝酸中并加热,固体和硝酸恰好完全反应,并产生标准状况下的NO2.24L(标准状况下);将另一份在空气中充分加热,的到n g固体,将所得固体溶于上述稀硝酸,消耗硝酸的体积为V ml。下列说法不正确的是
A.V=150Ml
B.硝酸的浓度为2 mol·L-1
C.m g铜粉和锌粉的物质的量之和为0.3 mol
D.n=m+2.4
【答案】D
【解析】
其中一份与200mL的稀硝酸恰好完全反应,溶液中溶质为Cu(NO3)2、Zn(NO3)2,NO的物质的量为2.24L÷22.4L/mol=0.1mol,转移电子为0.1mol×(5﹣2)=0.3mol,金属都表现+2,根据电子转移守恒可知n(Cu)+n(Zn)=0.3mol÷2=0.15mol,故溶液中NO3﹣的物质的量为:0.15mol×2=0.3mol,由N原子守恒可知200mL溶液中HNO3的物质的量为:0.1mol+0.3mol=0.4mol,根据c=![]() 可得HNO3的物质的量浓度;
可得HNO3的物质的量浓度;
将另一份在空气中充分加热,得到ng固体为CuO、ZnO,氧原子物质的量等于金属的物质的量,固体质量=每一份中金属总质量+固体中氧元素质量。将所得固体溶于上述稀硝酸溶解也生成Cu(NO3)2、Zn(NO3)2,根据金属总物质的量可知消耗HNO3的物质的量,再根据V=![]() 计算消耗硝酸的体积。
计算消耗硝酸的体积。
其中一份与200mL的稀硝酸恰好完全反应,溶液中溶质为Cu(NO3)2、Zn(NO3)2,NO的物质的量为2.24L÷22.4L/mol=0.1mol,转移电子为0.1mol×(5﹣2)=0.3mol,金属都表现+2,根据电子转移守恒可知n(Cu)+n(Zn)=0.3mol÷2=0.15mol,故溶液中NO3﹣的物质的量为:0.15mol×2=0.3mol,由N原子守恒可知200mL溶液中HNO3的物质的量为:0.1mol+0.3mol=0.4mol,故HNO3的物质的量浓度为:0.4mol÷0.2L=2mol/L;
A.反应后溶液中Cu(NO3)2、Zn(NO3)2,可知消耗HNO3的物质的量为0.15mol×2=0.3mol,故消耗硝酸的体积为0.3mol÷2mol/L=0.15L,即150mL,故A正确;
B.由分析可知,HNO3的物质的量浓度为:0.4mol÷0.2L=2mol/L,故B正确;
C.每一份中n(Cu)+n(Zn)=0.15mol,则mg铜粉和锌粉的物质的量之和为0.15mol×2=0.3mol,故C正确;
D.每一份中金属总质量为0.5m g,得到ng固体为CuO、ZnO,n(O)=n(Cu)+n(Zn)=0.15mol,则ng=0.5mg+0.15mol×16g/mol=(0.5m+2.4)g,故D错误;
故答案为D。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】某100mL溶液可能含有 Na+、NH4+、Fe3+、CO32-、SO42-、Cl-中的若干种,取该溶液进行连续实验,实验过程如图:(所加试剂均过量,气体全部逸出)下列说法正确的是

A. 若原溶液中不存在 Na+,则 c(Cl-)<0.1molL﹣1
B. 原溶液可能存在 Cl- 和 Na+
C. 原溶液中 c(CO32-)是 0.01molL﹣1
D. 原溶液一定存在 CO32-和SO42-,一定不存在 Fe3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是某元素的价类二维图,A为正盐,通常条件下Z是无色溶液,D的相对分子质量比E小16,各物质转化关系如图所示。下列说法不正确的是
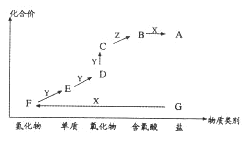
A.若X是一种强碱,则F为硝酸
B.若X是一种强酸,则F为硫酸
C.B和F在一定条件下均能发生反应,且都生成
D.B在一定条件下可直接与Y反应生成D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烃A的相对分子质量为84。回答下列问题:
(1)烃A的分子式为__。下列物质与A以任意比例混合,若总物质的量一定,充分燃烧消耗氧气的量不变的是_____;若总质量一定,充分燃烧消耗氧气的量不变的是_____。
A.C7H8 B.C6H14 C.C7H14 D.C8H8
(2)若烃A分子中所有的碳原子在同一平面上,且该分子的一氯取代物只有一种。则A的结构简式为__。若A不能使溴水褪色,且其一氯代物只有一种,则A的结构简式为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如下:


可能用到的有关数据如下:
相对分子质量 | 密度/(g·cm-3) | 沸点/℃ | 溶解性 | |
环己醇 | 100 | 0.9618 | 161 | 微溶于水 |
环己烯 | 82 | 0.8102 | 83 | 难溶于水 |
合成反应:在a中加入20g环己醇和2小片碎瓷片,冷却搅动下慢慢加入1mL浓H2SO4,b中通入冷却水后,开始缓慢加热a,控制馏出物的温度不超过90℃。
分离提纯:反应粗产物倒入分液漏斗中分别用少量5%碳酸钠溶液和水洗涤,分离后加入无水氯化钙颗粒,静置一段时间后弃去氯化钙,最终通过蒸馏得到纯净环己烯10g。回答下列问题:
(1)装置b的名称是__。
(2)加热一段时间后发现忘记加瓷片,应该采取的正确操作是__。
A.立即补加 B.冷却后补加 C.不需补加 D.重新配料
(3)本实验中最容易产生的副产物的结构简式为__。
(4)分离提纯过程中加入无水氯化钙的目的是__。
(5)本实验所得到的环己烯产率是__(填正确答案标号)。
A.41% B.50% C.61% D.70%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温度为T1时,向容积为2 L 的密闭容器甲、乙中分别充入一定量的CO(g)和H2O(g),发生反应:CO(g) + H2O(g) ![]() CO2(g) + H2(g) H = -41 kJ/mol。数据如下,下列说法不正确的是
CO2(g) + H2(g) H = -41 kJ/mol。数据如下,下列说法不正确的是
容器 | 甲 | 乙 | ||
反应物 | CO | H2O | CO | H2O |
起始时物质的量(mol) | 1.2 | 0.6 | 2.4 | 1.2 |
平衡时物质的量(mol) | 0.8 | 0.2 | a | b |
A. 甲容器中,平衡时,反应放出的热量为16.4 kJ
B. T1时,反应的平衡常数K甲 = 1
C. 平衡时,乙中CO的浓度是甲中的2倍
D. 乙容器中,平衡时CO的转化率约为75%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向1 L 0.1 mol·L-1一元酸HR溶液中逐渐通入氨气[已知常温下NH3·H2O电离平衡常数K=1.76×10-5],使溶液温度和体积保持不变,混合溶液的pH与离子浓度变化的关系如下图所示。下列叙述正确的是

A. 0.1 mol·L-1 HR溶液的pH为5
B. HR为弱酸,常温时随着氨气的通入,c(R-)/[c(OH-).c(HR)] 逐渐增大
C. 当通入0.1 mol NH3时,c(NH4+)>c(R-)>c(OH-)>c(H+)
D. 当c(R-)= c(HR)时,溶液必为中性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列做法符合原子经济性原理的是
A.SO3与H2O反应制取硫酸:SO3+H2O=H2SO4
B.用氢氧化钠溶液吸收SO2:SO2+2NaOH=Na2SO3+H2O
C.CO2与H2反应制取甲醇:CO2+3H2 CH3OH+H2O
CH3OH+H2O
D.H2还原氧化铜:H2+CuO![]() Cu+H2O
Cu+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌是一种常用金属,工业上利用锌焙砂(主要含ZnO、ZnFe2O4,还含有少量CaO、FeO、CuO、NiO 等)湿法制取金属锌的流程如图所示,回答下列问题。

已知:Fe的活泼性强于Ni。
(1)ZnFe2O4可写成ZnOFe2O3,则ZnFe2O4与H2SO4反应的化学方程式___。
(2)“净化Ⅰ”操作分为两步:
①将溶液中少量的 Fe2+氧化,下列试剂中可选用的是_____(填字母标号)。
A.新制氯水 B.30 % H2O2溶液 C.FeC13溶液 D.KMnO4溶液
②加入ZnO,调节溶液pH为3.3~6.7;加热到60℃左右并不断搅拌,加热搅拌主要目的是___。
(3)“净化Ⅰ”生成的沉淀中还含有溶液中的悬浮杂质,溶液中的悬浮杂质被共同沉淀的原因是____。
(4)“净化Ⅱ”中加入过量Zn的目的是______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com