
【题目】Ⅰ.甲硅烷(SiH4)常温下是一种无色气体,遇空气发生自燃。
(1)甲硅烷中含有的化学键是___,其在固态时属于___晶体。
(2)室温下1g甲硅烷燃烧生成SiO2和H2O放热44.6kJ,其热化学方程式为___。
Ⅱ.①CaCO3(s)=CaO(s)+CO2(g) △H=178.2kJmol-1
②2Na(s)+Cl2(g)=2NaCl(s) △H=-822.0kJmol-1
则:
(3)上述反应①②中属于放热反应的是___(填序号)。
(4)根据②计算生成1molNaCl(s)时,△H=___kJmol-1
Ⅲ.氢氧燃料电池是符合绿色化学理念的新型发电装置。如图为电池示意图。该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定。请回答:
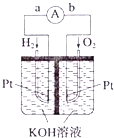
(5)氢氧燃料电池的能量转化形式主要是___。在导线中电子流动方向为___(用a、b表示)。
(6)负极反应式为___。
(7)金属锂是一种重要的储氢材料,吸氢和放氢原理如下:2Li+H2=2LiH,LiH+H2O=LiOH+H2↑,则2mol锂储氢后释放出的H2可以消耗标准状态O2的体积是___L。
【答案】共价键 分子 SiH4(g)+2O2(g)=SiO2(s)+2H2O(l) △H=-1427.2kJ/mol ② -411.0kJ·mol-1 化学能转化为电能 a→b 2H2+4OH--4e-=4H2O或H2+2OH--2e-=2H2O 22.4
【解析】
Ⅰ、![]() 由非金属形成的化合物,非金属元素之间的化学键为共价键,
由非金属形成的化合物,非金属元素之间的化学键为共价键,![]() 在常温下为气体,沸点较低,应为分子晶体。答案为:共价键;分子;
在常温下为气体,沸点较低,应为分子晶体。答案为:共价键;分子;
![]() 甲硅烷的物质的量为
甲硅烷的物质的量为![]() ,放出
,放出![]() 的热量,则1mol甲硅烷完全燃烧放出的热量为
的热量,则1mol甲硅烷完全燃烧放出的热量为![]() ,热化学方程式为
,热化学方程式为![]()
![]() 。
。
Ⅱ、![]() 据热化学方程式,
据热化学方程式,![]()
![]() 可知
可知![]() 为吸热反应,
为吸热反应,![]() 为放热反应。答案为:
为放热反应。答案为:![]() ;
;
![]() 生成2molNaCl放出
生成2molNaCl放出![]() 热量,则生成1molNaCl放出其一半的热量,为411kJ热量。答案为:-411.0kJ·mol-1;
热量,则生成1molNaCl放出其一半的热量,为411kJ热量。答案为:-411.0kJ·mol-1;
Ⅲ、![]() 该装置是把化学物质中的能量转化为电能,所以是化学能转变为电能;在原电池中,负极上失电子,正极上得电子,电子的流向是从负极流向正极,所以是由a到b。答案为:化学能转化为电能;
该装置是把化学物质中的能量转化为电能,所以是化学能转变为电能;在原电池中,负极上失电子,正极上得电子,电子的流向是从负极流向正极,所以是由a到b。答案为:化学能转化为电能;![]() ;
;
![]() 该反应中负极上氢气失电子生成氢离子而被氧化,所以电极反应式为
该反应中负极上氢气失电子生成氢离子而被氧化,所以电极反应式为![]() 或
或![]() 。
。
![]() 据吸氢和放氢原理可知,2mol锂储氢后生成2molLiH,释放2mol氢气,span>2mol氢气能够消耗1mol氧气,1mol氧气在标准状况下体积为
据吸氢和放氢原理可知,2mol锂储氢后生成2molLiH,释放2mol氢气,span>2mol氢气能够消耗1mol氧气,1mol氧气在标准状况下体积为![]() 。
。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】常温下,向1 L 0.1 mol·L-1一元酸HR溶液中逐渐通入氨气[已知常温下NH3·H2O电离平衡常数K=1.76×10-5],使溶液温度和体积保持不变,混合溶液的pH与离子浓度变化的关系如下图所示。下列叙述正确的是

A. 0.1 mol·L-1 HR溶液的pH为5
B. HR为弱酸,常温时随着氨气的通入,c(R-)/[c(OH-).c(HR)] 逐渐增大
C. 当通入0.1 mol NH3时,c(NH4+)>c(R-)>c(OH-)>c(H+)
D. 当c(R-)= c(HR)时,溶液必为中性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学进行影响草酸溶液与高锰酸钾酸性溶液反应速率因素的研究。室温下,实验数据如下:
实验序号 | ① | ② | ③ |
加入试剂 | 4mL 0.01mol/L KMnO4 2mL 0.1mol/L H2C2O4 | 4mL 0.01mol/L KMnO4 2mL 0.1mol/L H2C2O4 少量MnSO4固体 | 4mL 0.01mol/L KMnO4 2mL 0.1mol/L H2C2O4 少量Na2SO4固体 |
褪色时间/s | 116 | 6 | 117 |
(1)草酸溶液与高锰酸钾酸性溶液反应的离子方程式为___________________。
(2)该实验结论是_______________________。
(3)进行上述三个实验后,该同学进行反思,认为实验①的现象可以证明上述结论。请写出实验①的现象为____________________。
(4)实验②选用MnSO4固体而不是MnCl2固体的原因是_________________。
(5)该同学拟采用如下图所示的实验方案继续探究外界条件对反应速率的影响。

a.该同学拟研究的影响因素是___________________。
b.你认为该同学的实验方案_______________(填“合理”或“不合理”),理由是____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌是一种常用金属,工业上利用锌焙砂(主要含ZnO、ZnFe2O4,还含有少量CaO、FeO、CuO、NiO 等)湿法制取金属锌的流程如图所示,回答下列问题。

已知:Fe的活泼性强于Ni。
(1)ZnFe2O4可写成ZnOFe2O3,则ZnFe2O4与H2SO4反应的化学方程式___。
(2)“净化Ⅰ”操作分为两步:
①将溶液中少量的 Fe2+氧化,下列试剂中可选用的是_____(填字母标号)。
A.新制氯水 B.30 % H2O2溶液 C.FeC13溶液 D.KMnO4溶液
②加入ZnO,调节溶液pH为3.3~6.7;加热到60℃左右并不断搅拌,加热搅拌主要目的是___。
(3)“净化Ⅰ”生成的沉淀中还含有溶液中的悬浮杂质,溶液中的悬浮杂质被共同沉淀的原因是____。
(4)“净化Ⅱ”中加入过量Zn的目的是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由Cu、N、B等元素组成的新型材料有着广泛用途。
(1)基态 Cu+ 的核外电子排布式为____________。在高温下CuO 能分解生成Cu2O,试从原子结构角度解释其原因:_______________________________。
(2)立方氮化硼是一种新型的超硬、耐磨、耐高温的结构材料,它属于____晶体。
(3)化合物A (H3BNH3) 是一种潜在的储氢材料,它可由六元环状化合物 (HB=NH)3通过3CH4+ 2 (HB=NH)3+ 6H2O →3CO2 + 6H3BNH3 制得。
①与上述化学方程式有关的叙述不正确的是_________。(填标号)
A.反应前后碳原子的轨道杂化类型不变 |
B.CH4、H2O、CO2分子空间构型分别是:正四面体形、V形、直线形 |
C.第一电离能:N>O>C>B |
D.化合物A中存在配位键 |
②1个 (HB=NH)3分子中有__个σ键。
(4)在硼酸盐中,阴离子有链状、环状等多种结构形式。图(a)是一种链状结构的多硼酸根,则多硼酸根离子符号为________。图(b)是硼砂晶体中阴离子的环状结构,其中硼原子采取的杂化类型为_________。


查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W、Q、R均为前四周期元素,且原子序数依次增大。其相关信息如下表所示:
X元素的基态原子中电子分布在三个不同的能级中,且每个能级中的电子总数相同 |
Y元素的气态氢化物与其最高价氧化物对应的水化物能发生化合反应 |
Z元素的族序数是其周期数的三倍 |
W原子的第一至第六电离能分别为:I1=578KJ·mol-1I2=1817KJ·mol-1I3=2745KJ·mol-1 I4=11575KJ·mol-1I5=14830KJ·mol-1I6=18376KJ·mol-1 |
Q为前四周期中电负性最小的元素 |
元素R位于周期表的第10列 |
回答下列问题:
(1)Y元素的基态原子中未成对电子数为______;X、Y、Z三种元素原子的第一电离能由小到大的顺序为____________(用元素符号表示)。
(2)W的氯化物的熔点比Q的氯化物的熔点__________(填“高”或“低”),理由是__________________________________________________。
(3)光谱证实元素W的单质与强碱性溶液反应有[W(OH)4]-生成,则[W(OH)4]-中存在(填字母)_____________。
a.极性共价键 b.非极性共价键 c.配位键 d.氢键
(4)含有X、R和镁三种元素的某种晶体具有超导性,其结构如下图所示。则该晶体的化学式为_______;晶体中每个镁原子周围距离最近的R原子有_______个。
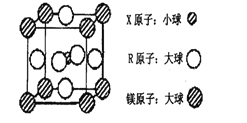
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.根据图中数据,回答下列问题:

①该反应在_________min时达到化学平衡状态。
②该反应的化学方程式是______________________。
③从开始到2min,Z的平均反应速率是________________________。
(2)某原电池的装置如图所示,看到a极上有红色金属析出,回答下列问题:

①若a、b是两种活动性不同的金属,则活动性a____b(填>、<或=);
②电路中的电子从____经导线流向_____(填a或b);
③溶液中的SO42-向________极移动(填a或b);
④若两电极分别是Al和C,则负极的电极反应式为_________________。
(3)将甲醇与氧气分别通入如图所示的装置的电极中,可构成甲醇燃料电池,请回答下列问题:

通入甲醇的电极是_____(填“正”或“负”)极,反应时该电极附近的现象是_____________________________,溶液中K+向____(填“正”或“负”)极移动:写出正极反应式:_______________;若电池工作过程中通过2mol电子,则理论上消耗O2__L(标准状况)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用0.1 mol·L-1 NaOH溶液滴定40 mL 0.1 mol·L-1 H2SO3溶液,所得滴定曲线如图所示(忽略混合时溶液体积的变化)。下列叙述错误的是( )
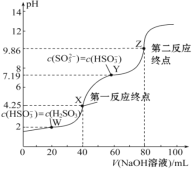
A. Ka2(H2SO3)的数量级为10-8
B. 若滴定到第一反应终点,可用甲基橙作指示剂
C. 图中Z点对应的溶液中:c(Na+)>c(SO32-)>c(HSO3-)>c(OH-)
D. 图中Y点对应的溶液中:3c(SO32-)=c(Na+)+c(H+)-c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烧杯中盛有含0.2 mol NH4Al(SO4)2的溶液,向其中缓缓加入4 mol·L-1的NaOH溶液200 mL,使其充分反应,此时烧杯中铝元素的存在形式为( )
A. Al3+和Al(OH)3 B. AlO2— C. AlO2—和Al(OH)3 D. Al(OH)3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com