
【题目】用0.1 mol·L-1 NaOH溶液滴定40 mL 0.1 mol·L-1 H2SO3溶液,所得滴定曲线如图所示(忽略混合时溶液体积的变化)。下列叙述错误的是( )
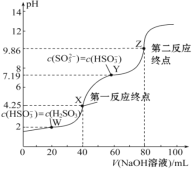
A. Ka2(H2SO3)的数量级为10-8
B. 若滴定到第一反应终点,可用甲基橙作指示剂
C. 图中Z点对应的溶液中:c(Na+)>c(SO32-)>c(HSO3-)>c(OH-)
D. 图中Y点对应的溶液中:3c(SO32-)=c(Na+)+c(H+)-c(OH-)
【答案】C
【解析】
用0.1mol/LNaOH溶液滴定40mL0.1mol/LH2SO4溶液,由于H2SO3是二元酸,滴定过程中存在两个化学计量点,滴定反应为:NaOH+H2SO3═NaHSO3+H2O,NaHSO3+NaOH═Na2SO3+H2O,完全滴定需要消耗NaOH溶液的体积为80mL,结合溶液中的守恒思想分析判断。
A.由图像可知,当溶液中c(HSO3-)= c(SO32-)时,此时pH=7.19,即c(H+)=10-7.19mol/L,则H2SO3的Ka2=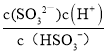 =c(H+),所以H2SO3的Ka2=1×10-7.19,Ka2(H2SO3)的数量级为10-8,故A正确;
=c(H+),所以H2SO3的Ka2=1×10-7.19,Ka2(H2SO3)的数量级为10-8,故A正确;
B.第一反应终点时,溶液中恰好存在NaHSO3,根据图像,此时溶液pH=4.25,甲基橙的变色范围为3.1~4.4,可用甲基橙作指示剂,故B正确;
C.Z点为第二反应终点,此时溶液中恰好存在Na2SO3,溶液pH=9.86,溶液显碱性,表明SO32-会水解,考虑水也存在电离平衡,因此溶液中c(OH-)>c(HSO3-),故C错误;
D.根据图像,Y点溶液中c(HSO3-)=c(SO32-),根据电荷守恒,c(Na+)+c(H+)=c(OH-)+c(HSO3-)+2c(SO32-),由于c(HSO3-)=c(SO32-),所以3c(SO32-)=c(Na+)+c(H+)-c(OH-),故D正确;
答案选C。


科目:高中化学 来源: 题型:
【题目】CO2资源化利用的方法之一是合成二甲醚(CH3OCH3)。
(1)CO2 催化加氢合成二甲醚的过程中主要发生下列反应:
反应I: CO2(g) + H2(g) ![]() CO(g) + H2O(g) H= + 41.2 kJ·mol1
CO(g) + H2O(g) H= + 41.2 kJ·mol1
反应II:2CO2(g) + 6H2(g) ![]() CH3OCH3(g) + 3H2O(g) H = -122.5 kJ·mol1
CH3OCH3(g) + 3H2O(g) H = -122.5 kJ·mol1
其中,反应II分以下①、②两步完成,请写出反应①的热化学方程式:①___________
② 2CH3OH(g) ![]() CH3OCH3(g) + H2O(g) H = -23.5 kJ·mol1
CH3OCH3(g) + H2O(g) H = -23.5 kJ·mol1
(2)二甲醚直接燃料电池具有启动快、效率高等优点。若电解质为碱性,二甲醚直接燃料电池的负极反应式为____________。以该电池为电源,用惰性电极电解饱和食盐水的化学方程式为________。
(3)反应I产生的CO,有人设想按下列反应除去:2CO(g) = 2C(s) + O2(g),已知该反应的H>0,简述该设想能否实现的依据_____________。
(4)CO2在自然界循环时可与CaCO3反应,Ksp(CaCO3)=2.8×109。 CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为5.6×105mol·L1,则生成沉淀所需CaCl2溶液的最小浓度为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.甲硅烷(SiH4)常温下是一种无色气体,遇空气发生自燃。
(1)甲硅烷中含有的化学键是___,其在固态时属于___晶体。
(2)室温下1g甲硅烷燃烧生成SiO2和H2O放热44.6kJ,其热化学方程式为___。
Ⅱ.①CaCO3(s)=CaO(s)+CO2(g) △H=178.2kJmol-1
②2Na(s)+Cl2(g)=2NaCl(s) △H=-822.0kJmol-1
则:
(3)上述反应①②中属于放热反应的是___(填序号)。
(4)根据②计算生成1molNaCl(s)时,△H=___kJmol-1
Ⅲ.氢氧燃料电池是符合绿色化学理念的新型发电装置。如图为电池示意图。该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定。请回答:
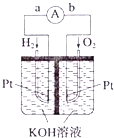
(5)氢氧燃料电池的能量转化形式主要是___。在导线中电子流动方向为___(用a、b表示)。
(6)负极反应式为___。
(7)金属锂是一种重要的储氢材料,吸氢和放氢原理如下:2Li+H2=2LiH,LiH+H2O=LiOH+H2↑,则2mol锂储氢后释放出的H2可以消耗标准状态O2的体积是___L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在照相底片的定影过程中,未曝光的溴化银(AgBr)常用硫代硫酸钠(Na2S2O3)溶解,反应生成Na3[Ag(S2O3)2];在废定影液中加入Na2S使Na3[Ag(S2O3)2]中的银转化为Ag2S,并使定影液再生。将Ag2S在高温下转化为Ag,就达到了回收银的目的。
(1)铜、银、金在元素周期表中位于同一族相邻周期,基态铜原子的价电子排布式为___。
(2)Na、O、S简单离子半径由大到小的顺序为___。
(3)S2O32-离子结构如图所示,其中心硫原子的杂化轨道类型为___。
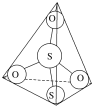
(4)Na3[Ag(S2O3)2]中存在的作用力有__。
A.离子键 B.共价键 C.范德华力 D.金属键 E.配位键
(5)在空气中灼烧Ag2S生成Ag和SO2,SO2分子中硫原子的价层电子对数为__,其分子空间构型为___。SO2易溶于水,原因是__。
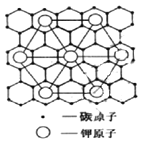
(6)SO2具有较强的还原性,碳与熔融金属钾作用,形成的晶体是已知最强的还原剂之一,碳的某种晶体为层状结构,钾原子填充在各层之间,形成间隙化合物,其常见结构的平面投影如图所示,则其化学式可表示为___。
(7)现在人们已经有多种方法来测定阿伏加德罗常数,X射线衍射法就是其中的一种,通过对金晶体的X 射线衍射图像的分析,可以得出金晶体的晶胞属于面心立方晶胞(与铜的晶胞相似)。若金原子的半径为am,金的密度为ρg·cm-3,金的摩尔质量为Mg·mol-1,试通过这些数据列出计算阿伏加德罗常数的算式___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人体必须的元素之一,海洋植物如海带、海藻中含有丰富的、以碘离子形式存在的碘元素。在实验室中,从海藻里提取碘的流程和实验装置如下:
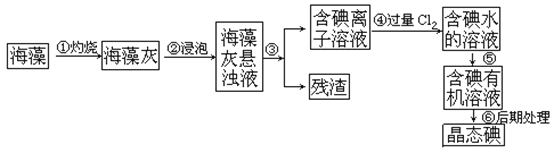
(1)指出上述提取碘的过程中有关实验操作的名称:步骤③______,步骤⑤______。
(2)写出步骤④对应反应的离子方程式:______________________________。
(3)提取碘的过程中,可供选择的有机试剂是_______________。
A.酒精 B.醋酸 C.四氯化碳 D.苯
(4)为了使海藻灰中的碘离子转化为碘的有机溶液,即完成步骤③至⑤,实验室里有烧杯、玻璃棒、集气瓶、酒精灯、导管、圆底烧瓶、石棉网以及必要的夹持仪器和物品,尚缺少的玻璃仪器是_________________________________________________________。
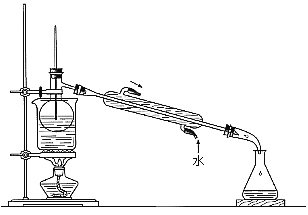
(5)从含碘的有机溶剂中提取碘和回收有机溶剂,还需要经过蒸馏。指出下图实验装置中存在的错误之处:_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列实验现象,所得结论错误的是
实验 | 实验现象 | 结论 |
A |
| 活动性:Al>Fe>Cu |
B |
| 铜与浓硝酸的反应产物是NO |
C |
| 增大反应物浓度,平衡向正反应方向移动 |
D |
| 装置气密性良好 |
A.AB.BC.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜及其化合物在工业生产和日常生活中有着广泛的应用。
某化学小组拟采用如下装置(夹持和加热仪器已略去)来测定铜的相对原子质量,同时检验氯气的氧化性。
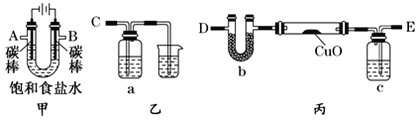
(1)装置甲中发生反应的化学方程式是:__________。
(2)已知装置甲中B处有黄绿色的气体产生,且 B连C ;则A连________(填写连接的字母)。
(3)乙装置的a瓶中溶液可以是________(填标号)
A 酸性KMnO4溶液 B CCl4溶液 C 滴加有KSCN溶液的FeCl2溶液 D 饱和食盐水
(4)在检查装置气密性后,加热丙装置硬质玻璃管里的CuO粉末前,还需要进行的操作为________。
(5)准确称量m g CuO进行实验,当CuO完全反应后测出b中增重n g。则Cu的相对原子质量为____________(只要求列出算式)。该实验方案的装置有不合理之处,若不加以改进会导致测定结果__________ (填“偏大”、“偏小”或“不变”)。
(6)利用焰色反应的原理既可制作五彩缤纷的节日烟花,亦可定性鉴别某些金属盐。灼烧CuCl2样品时,铜的焰色为__________(填标号)。
A 绿色 B 红色 C 紫色 D 黄色
(7)向CuCl2溶液中通人H2S气体,可产生CuS沉淀,反应离子方程式为:Cu2+ + H2S=CuS(s) + 2H+,则该反应的平衡常数K=_________(保留一位小数)。已知:CuS溶度积Ksp=1.0×10-36,H2S电离常数Ka1=1.3×10-7,Ka2=7.0×10-15。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】类比![]() 比较
比较![]() 是研究物质性质的常用方法之一,可预测许多物质的性质。但类比是相对的,不能违背客观实际。下列说法正确的是
是研究物质性质的常用方法之一,可预测许多物质的性质。但类比是相对的,不能违背客观实际。下列说法正确的是![]()
A.![]() 能水解:
能水解:![]() ,则
,则![]() 也能水解:
也能水解:![]()
B.![]() 与Cu加热反应生成CuO,则S与Cu加热反应生成CuS
与Cu加热反应生成CuO,则S与Cu加热反应生成CuS
C.根据化合价![]() 可表示为
可表示为![]() ,则
,则![]() 也可表示为
也可表示为![]()
D.![]() 通入
通入![]() 溶液中不产生沉淀,则
溶液中不产生沉淀,则![]() 通入
通入![]() 溶液中也不产生沉淀
溶液中也不产生沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向含Al2(SO4)3和AlCl3的混合溶液中逐滴加人1mol/L Ba(OH)2溶液至过量,加入Ba(OH)2溶液的体积和所得沉淀的物质的量的关系如图,下列说法不正确的是( )

A. 图中C点铝元素存在形式是AlO2—
B. 向D点溶液中通人C02气体,立即产生白色沉淀
C. 原混合液中c[Al2(SO4)3]:c(AlCl3)=1:2
D. OA段反应的离子方程式为:3Ba2++2Al3++8OH-+3SO4=BaSO4↓+2AlO2-+4H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com