
【题目】下列元素中金属性最强的是( )
A. K B. Na C. Al D. Mg
科目:高中化学 来源: 题型:
【题目】 O2F2可以发生反应:H2S+4O2F2→SF6+2HF+4O2,下列说法正确的是( )
A.氧气是氧化产物 B.若生成4.48 L HF,则转移0.8 mol电子
C.O2F2既是氧化剂又是还原剂 D.还原剂与氧化剂的物质的量之比为1:4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是( )
A.0.1 mol羟基中含有的电子数为0.9 NA
B.标准状况下,12g金刚石中含共价键的数目为4NA
C.0.1 mol N2与足量H2充分反应,转移的电子数为0.6 NA
D.235g核素![]() 发生裂变反应:
发生裂变反应:![]() 净产生的中子(
净产生的中子(![]() )数为10NA
)数为10NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】早期发现的一种天然二十面体准晶颗粒由Al、Cu、Fe三种金属元素组成。回答下列问题:
(1)准晶是一种无平移周期序,但有严格准周期位置序的独特晶体,可通过________方法区别晶体、准晶体和非晶体。
(2)基态Fe原子有_________个未成对电子,Fe3+的电子排布式为 _。可用硫氰化钾检验Fe3+,现象是 。
(3)根据价层电子对互斥理论判断:SO42—的立体构型为_ ,H3O+ 的立体构型为 。
(4)新制的Cu(OH)2可将乙醛(CH3CHO)氧化成乙酸,而自身还原成Cu2O。乙醛中碳原子的杂化轨道为___________,1mol乙醛分子中含有的![]() 键的数目为___________。Cu2O为半导体材料,在其立方晶胞内部有4个氧原子,其余氧原子位于面心和顶点,则该晶胞中有 个铜原子。
键的数目为___________。Cu2O为半导体材料,在其立方晶胞内部有4个氧原子,其余氧原子位于面心和顶点,则该晶胞中有 个铜原子。
(5)Al单质为面心立方晶体,其晶胞如图。晶胞中铝原子的配位数为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)H2S和H2Se的参数对比见右表。
化学式 | 键长/nm | 键角 | 沸点/℃ |
H2S | 1.34 | 92.3° | -60.75 |
H2Se | 1.47 | 91.0° | -41.50 |
①H2Se的晶体类型为__________________;
②H2S的键角大于H2Se的原因可能__________________;
分子晶体
;;
(2)硒为第四周期ⅥA族元素,与其相邻的元素有砷(33号)、溴(35号),则三种元素的电负性由小到大的顺序为___;(用元素符号表示)
(3)一种铜金合金晶体具有面心立方最密堆积结构,在晶胞中金原子位于顶点,铜原子位于面心,则该合金中金原子(Au)与铜原子(Cu)个数比为____________1:3
;若该晶体的晶胞参数为a pm,则该合金密度
为_______________g/cm3。(列出计算式,不要求计算结果,阿伏伽德罗数的值为NA)
(4)Fe(CO)5与NH3在一定条件下可合成一种具有磁性的氮化铁。
①1molFe(CO)5分子中含有σ键的数目为____________1:3
;
②该磁性氮化铁晶胞结构如图所示,该化合物的化学式____________。1:3
。。。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(14分)铜是一种常见的金属元素,其有多种用途广泛的化合物。
I、氯化亚铜(CuCl)是一种白色粉末,不溶于乙醇,微溶于水,易溶于浓盐酸,露置在空气中迅速被氧化成碱式盐。可用于一氧化碳、乙炔等气体含量的测定。以粗铜(含Cu、Fe)为原料可制备纯净的CuCl,其流程如下:
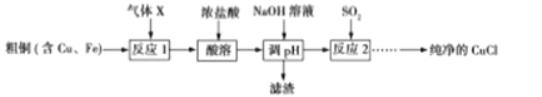
(1)气体X的化学式 ,“酸溶”采用浓盐酸的原因是 。
(2)“酸溶”所得溶液成分分析:c(CuCl2)=5mol·L-1,c(FeCl3)=1 mol·L-1。已知:Ksp[Fe(OH)3]=4.0×10-38,Ksp[Cu(OH)2]=4.8×10-20,当溶液中金属离子的浓度小于10-5 mol·L-1时可认为其沉淀完全,则上述流程中滴加NaOH溶液调节pH,其范围约为 (数值取整数)。
(3)反应2的离子方程式为 。
(4)设计实验提纯析出的CuCl粗晶体: 。
II、纳米氧化亚铜(Cu2O)可用作光电材料,可用电解法制得(如图)。酸性介质中Cu2O不能稳定存在,潮湿的空气中可缓慢被氧化成CuO。
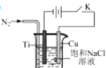
(5)阳极的电极反应式为: 。
(6)电解过程中从烧杯底部通入N2,其可能的作用:
①搅动溶液,使OH-迅速扩散;② 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,在一个2L的密闭容器中,X、Y、Z三种气态物质的物质的量随时间的变化曲线如图所示,由图中数据分析:

(1)该反应的化学方程式 。
(2)反应开始至2min,以Z表示的平均反应速率为 。
(3)反应达平衡此时体系的压强是开始时 倍。
(4)下列叙述能说明上述反应达到化学平衡状态的是 (填字母)
A.混合气体的总物质的量不随时间的变化而变化
B.单位时间内每消耗3mol X,同时生成2mol Z
C.混合气体的密度不随时间的变化而变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高锰酸钾(KMnO4)是一种常用的氧化剂。
(1)有下列变化:CO32-![]() CO2、C2O42-
CO2、C2O42-![]() CO2、Fe3+
CO2、Fe3+![]() Fe2+,找出其中一个变化与“MnO4-
Fe2+,找出其中一个变化与“MnO4-![]() Mn2+”组成一个反应,写出该反应的离子方程式:______________。
Mn2+”组成一个反应,写出该反应的离子方程式:______________。
(2)不同条件下高锰酸钾可发生如下反应:
MnO4-+5e-+8H+=Mn2++4H2O MnO4-+3e-+2H2O=MnO2+4OH- MnO4-+e-=MnO42-
由此可知,高锰酸根离子(MnO4-)反应后的产物与________有关。
(3)高锰酸钾溶液与硫化亚铁有如下反应:
10FeS+6KMnO4+24H2SO4=3K2SO4+6MnSO4+5Fe2(SO4)3+10S+24H2O若上述反应前后固体的质量减少了2.8g,则硫元素与KMnO4之间发生电子转移的数目为______个。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为了探索铝电极在原电池中的作用,设计并进行了以下一系列实验,实验结果记录如下:
编号 | 电极材料 | 电解质溶液 | 电流指针偏转方向 |
1 | Mg Al | 稀盐酸 | 偏向Al |
2 | Al Cu | 稀盐酸 | 偏向Cu |
3 | Al 石墨 | 稀盐酸 | 偏向石墨 |
4 | Mg Al | NaOH溶液 | 偏向Mg |
5 | Al Zn | 浓硝酸 | 偏向Al |
试根据上表中的实验现象回答下列问题:
(1)实验1、2中Al所作的电极是否相同? .
(2)实验1、4中Al所作的电极是否相同? .
(3)写出实验3中的电极反应式.正极: ;
(4)用电子式表示氯化镁的形成过程:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com