
【题目】(14分)铜是一种常见的金属元素,其有多种用途广泛的化合物。
I、氯化亚铜(CuCl)是一种白色粉末,不溶于乙醇,微溶于水,易溶于浓盐酸,露置在空气中迅速被氧化成碱式盐。可用于一氧化碳、乙炔等气体含量的测定。以粗铜(含Cu、Fe)为原料可制备纯净的CuCl,其流程如下:
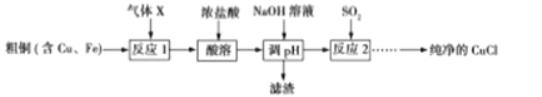
(1)气体X的化学式 ,“酸溶”采用浓盐酸的原因是 。
(2)“酸溶”所得溶液成分分析:c(CuCl2)=5mol·L-1,c(FeCl3)=1 mol·L-1。已知:Ksp[Fe(OH)3]=4.0×10-38,Ksp[Cu(OH)2]=4.8×10-20,当溶液中金属离子的浓度小于10-5 mol·L-1时可认为其沉淀完全,则上述流程中滴加NaOH溶液调节pH,其范围约为 (数值取整数)。
(3)反应2的离子方程式为 。
(4)设计实验提纯析出的CuCl粗晶体: 。
II、纳米氧化亚铜(Cu2O)可用作光电材料,可用电解法制得(如图)。酸性介质中Cu2O不能稳定存在,潮湿的空气中可缓慢被氧化成CuO。
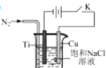
(5)阳极的电极反应式为: 。
(6)电解过程中从烧杯底部通入N2,其可能的作用:
①搅动溶液,使OH-迅速扩散;② 。
【答案】
(1)Cl2;抑制Fe3+、Cu2+的水解,且不引入杂质
(2)3~4
(3)2Cu2++SO2+2Cl-+2H2O=2CuCl↓+SO42-+4H+
(4)将CuCl粗晶体用蒸馏水洗涤后再用无水乙醇冲洗,最后真空烘干
(5)2Cu-2e-+2OH-=Cu2O+H2O
(6)作为保护气防止空气中的氧气氧化电解产生的Cu2O
【解析】
试题分析:I、(1)根据(2)的提示,反应1生成了CuCl2和FeCl3,因此气体X为氯气,“酸溶”采用浓盐酸可以抑制Fe3+、Cu2+的水解,且不引入杂质,故答案为:Cl2;抑制Fe3+、Cu2+的水解,且不引入杂质;
(2)溶度积常数越小的越先沉淀,根据溶度积常数知,先生成沉淀的是Fe(OH)3,当c(Fe3+)=10-5 mol·L-1时, c(OH-)=![]() =
=![]() ×10-11mol/L,此时溶液的pH在3~4之间,c2(OH-)·c(Cu2+)=(
×10-11mol/L,此时溶液的pH在3~4之间,c2(OH-)·c(Cu2+)=(![]() ×10-11mol/L)2×5mol·L-1<4.8×10-20,Cu2+不会沉淀,故答案为:3~4;
×10-11mol/L)2×5mol·L-1<4.8×10-20,Cu2+不会沉淀,故答案为:3~4;
(3)反应2是通入的二氧化硫将氯化铜还原为CuCl,离子方程式为2Cu2++SO2+2Cl-+2H2O=2CuCl↓+SO42-+4H+,故答案为:2Cu2++SO2+2Cl-+2H2O=2CuCl↓+SO42-+4H+;
(4)根据题意,氯化亚铜(CuCl)是一种白色粉末,不溶于乙醇,微溶于水,易溶于浓盐酸,露置在空气中迅速被氧化成碱式盐。提纯析出的CuCl粗晶体的步骤为:将CuCl粗晶体用蒸馏水洗涤后再用无水乙醇冲洗,最后真空烘干,故答案为:将CuCl粗晶体用蒸馏水洗涤后再用无水乙醇冲洗,最后真空烘干;
II、(5)阳极发生氧化反应,阳极铜失去电子生成铜两种,与溶液中阴极生成的氢氧根离子反应生成氧化亚铜,电极反应式为2Cu-2e-+2OH-=Cu2O+H2O,故答案为:2Cu-2e-+2OH-=Cu2O+H2O;
(6)电解过程中从烧杯底部通入N2,其可能的作用:①搅动溶液,使OH-迅速扩散;②作为保护气防止空气中的氧气氧化电解产生的Cu2O,故答案为:作为保护气防止空气中的氧气氧化电解产生的Cu2O。


 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案科目:高中化学 来源: 题型:
【题目】我国产铜主要取自黄铜矿(CuFeS2),随着矿石品味的降低和环保要求的提高,湿法炼铜的优势日益突出。该工艺的核心是黄铜矿的浸出,目前主要有氧化浸出、配位浸出和生物浸出三种方法。
I.氧化浸出
(1)在硫酸介质中用双氧水将黄铜矿氧化,测得有SO42-生成。
①该反应的离子方程式为 。
②该反应在25—50℃下进行,实际生产中双氧水的消耗量要远远高于理论值,试分析其原因为 。
Ⅱ.配位浸出
反应原理为:![]()
(2)为提高黄铜矿的浸出率,可采取的措施有 (至少写出两点)。
(3)为稳定浸出液的pH,生产中需要向氨水中添加NH4C1,构成NH3·H2O-NH4Cl缓冲溶液。某小组在实验室对该缓冲体系进行了研究:25℃时,向amol·L-l的氨水中缓慢加入等体积0.02 mol·L-l的NH4C1溶液,平衡时溶液呈中性。则NH3·H2O的电离常数Kb= (用含a的代数式表示);滴加NH4C1溶液的过程中水的电离平衡 (填“正向”、“逆向”或“不”)移动。
Ⅲ.生物浸出
在反应釜中加入黄铜矿、硫酸铁、硫酸和微生物,并鼓入空气,黄铜矿逐渐溶解,反应釜中各物质的转化关系如图所示。
(4)在微生物的作用下,可以循环使用的物质有 (填化学式),微生物参与的离子反应方程式为____ (任写一个)。

(5)假如黄铜矿中的铁元素最终全部转化为Fe3+,当有2 mol SO42-生成时,理论上消耗O2的物质的量为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温常压下某CO2、H2、CO的混合气体与氮气的密度相同,则该混合气体中CO2、H2、CO的质量之比可能为( )
A.13:8:27 B.13:9:27 C.26:16:27 D.286:8:27
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对能量转化的认知中,不正确的是( )
A.电解水生成H2和O2时,电能主要转化为化学能
B.风力发电时,风能主要转化为电能
C.煤燃烧时,化学能主要转化为热能
D.白炽灯工作时,电能全部转化为光能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙、丁分别是甲烷、乙烯、丙烯(CH3—CH===CH2)、苯中的一种;
(1)甲、乙能使溴水褪色,甲分子中所有原子共平面,但乙分子不是所有原子共平面。
(2)丙既不能使Br2的CCl4溶液褪色,也不能使酸性KMnO4溶液褪色。
(3)丁既不能使Br2的CCl4溶液褪色,也不能使酸性KMnO4溶液褪色,但在一定条件下可与液溴发生取代反应。一定条件下,1 mol丁可以和3 mol H2完全加成。
请根据以上叙述完成下列填空:
(1)甲的结构简式________,乙的名称________,丙是________结构。
(2)丁与H2在催化剂作用下发生加成反应的化学方程式____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】进行化学实验时应强化安全意识。下列做法正确的是( )
A. 金属钠着火时使用泡沫灭火器灭火
B. 用试管加热碳酸氢钠固体时使试管口竖直向上
C. 浓硫酸溅到皮肤上时立即用稀氢氧化钠溶液沖洗
D. 做蒸馏实验时,如果在沸腾前发现忘记加沸石,应立即停止加热,冷却后补加
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaCN超标的电镀废水可用两段氧化法处理:
(1)NaCN与NaClO反应,生成NaOCN和NaCl
(2)NaOCN与NaClO反应,生成Na2CO3、CO2、NaCl和N2
已知HCN(Ki=6.3×10-10)有剧毒;HCN、HOCN中N元素的化合价相同.
完成下列填空:
(1)HClO的电子式为_________;
(2)第一次氧化时,溶液的pH应调节为_________(选填“酸性”、“碱性”或“中性”);原因是_________;
(4)写出第二次氧化时发生反应的离子方程式_________;
(3)处理100m3含NaCN 10.3mg/L的废水,实际至少需NaClO________ g(实际用量应为理论值的4倍),才能使NaCN含量低于0.5mg/L,达到排放标准。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 元素周期表有7个周期、18个族
B. 天然气是一种清洁的化石燃料
C. 工业上常用电解NaCl水溶液的方法制取金属钠
D. 淀粉和纤维素互为同分异构体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com