
【题目】NaCN超标的电镀废水可用两段氧化法处理:
(1)NaCN与NaClO反应,生成NaOCN和NaCl
(2)NaOCN与NaClO反应,生成Na2CO3、CO2、NaCl和N2
已知HCN(Ki=6.3×10-10)有剧毒;HCN、HOCN中N元素的化合价相同.
完成下列填空:
(1)HClO的电子式为_________;
(2)第一次氧化时,溶液的pH应调节为_________(选填“酸性”、“碱性”或“中性”);原因是_________;
(4)写出第二次氧化时发生反应的离子方程式_________;
(3)处理100m3含NaCN 10.3mg/L的废水,实际至少需NaClO________ g(实际用量应为理论值的4倍),才能使NaCN含量低于0.5mg/L,达到排放标准。
【答案】(1)![]() (2)碱性;防止生成HCN,造成人员中毒或污染空气。
(2)碱性;防止生成HCN,造成人员中毒或污染空气。
(3)2OCN-+3ClO-=CO32-+CO2↑+3Cl-+N2↑ (4)14 900
【解析】
试题分析:(1)HClO的电子式为![]() ;
;
(2)NaCN易与酸反应生成HCN,为防止生成HCN,造成人员中毒或污染空气,因此第一次氧化时,溶液的pH应调节为碱性;
(3)反应中氯元素的化合价从+1价降低到-1价,得到2个电子.N元素化合价从-3价升高到0价,失去3个电子,则根据电子得失守恒可知还原剂和氧化剂的物质的量之比是2:3,反应的离子方程式为:2OCN-+3ClO-=CO32-+CO2↑+3Cl-+N2↑;
(4)参加反应的NaCN是:![]() =20mol,反应中C由+2价升高到+4价,N元素化合价从-3价升高到0价,即1molNaCN失去5mol电子,1mol次氯酸钠得到2mol电子,所以处理100 m3含NaCN 10.3 mg/L的废水,实际至少需NaClO的质量为:
=20mol,反应中C由+2价升高到+4价,N元素化合价从-3价升高到0价,即1molNaCN失去5mol电子,1mol次氯酸钠得到2mol电子,所以处理100 m3含NaCN 10.3 mg/L的废水,实际至少需NaClO的质量为:![]() ×74.5g/mol×4=14900g。
×74.5g/mol×4=14900g。


科目:高中化学 来源: 题型:
【题目】下列各组物质能真实表示物质分子组成的是( )
A.NO、C2H5OH、HNO3、I2
B.CaO、N2、HCl、H2O
C.NH3、H2S、Fe、CO
D.CO2、SiO2、CH3COOH、H2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(14分)铜是一种常见的金属元素,其有多种用途广泛的化合物。
I、氯化亚铜(CuCl)是一种白色粉末,不溶于乙醇,微溶于水,易溶于浓盐酸,露置在空气中迅速被氧化成碱式盐。可用于一氧化碳、乙炔等气体含量的测定。以粗铜(含Cu、Fe)为原料可制备纯净的CuCl,其流程如下:
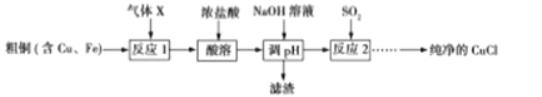
(1)气体X的化学式 ,“酸溶”采用浓盐酸的原因是 。
(2)“酸溶”所得溶液成分分析:c(CuCl2)=5mol·L-1,c(FeCl3)=1 mol·L-1。已知:Ksp[Fe(OH)3]=4.0×10-38,Ksp[Cu(OH)2]=4.8×10-20,当溶液中金属离子的浓度小于10-5 mol·L-1时可认为其沉淀完全,则上述流程中滴加NaOH溶液调节pH,其范围约为 (数值取整数)。
(3)反应2的离子方程式为 。
(4)设计实验提纯析出的CuCl粗晶体: 。
II、纳米氧化亚铜(Cu2O)可用作光电材料,可用电解法制得(如图)。酸性介质中Cu2O不能稳定存在,潮湿的空气中可缓慢被氧化成CuO。
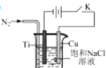
(5)阳极的电极反应式为: 。
(6)电解过程中从烧杯底部通入N2,其可能的作用:
①搅动溶液,使OH-迅速扩散;② 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z的原子序数依次增大。m、p、q、r、s是由这些元素组成的二元化合物,常温常压下r为液体,其余均为无色气体, m 的摩尔质量为p的2倍,n是元素Y的单质,是绿色植物光合作用产生的无色气体,p物质能使湿润的红色石蕊试纸变蓝,q能使品红溶液褪色。上述的转化关系如图所示。下列说法正确的是( )

A. 原子半径:X<Y<Z B. 非金属性:X>Y>Z
C. q与s均为酸性氧化物 D. X 的单质与Y 的单质在一定条件下能发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高锰酸钾(KMnO4)是一种常用的氧化剂。
(1)有下列变化:CO32-![]() CO2、C2O42-
CO2、C2O42-![]() CO2、Fe3+
CO2、Fe3+![]() Fe2+,找出其中一个变化与“MnO4-
Fe2+,找出其中一个变化与“MnO4-![]() Mn2+”组成一个反应,写出该反应的离子方程式:______________。
Mn2+”组成一个反应,写出该反应的离子方程式:______________。
(2)不同条件下高锰酸钾可发生如下反应:
MnO4-+5e-+8H+=Mn2++4H2O MnO4-+3e-+2H2O=MnO2+4OH- MnO4-+e-=MnO42-
由此可知,高锰酸根离子(MnO4-)反应后的产物与________有关。
(3)高锰酸钾溶液与硫化亚铁有如下反应:
10FeS+6KMnO4+24H2SO4=3K2SO4+6MnSO4+5Fe2(SO4)3+10S+24H2O若上述反应前后固体的质量减少了2.8g,则硫元素与KMnO4之间发生电子转移的数目为______个。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D都是中学化学常见的物质,其中A、B、C均含同一种元素。在一定条件下相互转化关系如下图所示(部分产物已略去)。请按要求回答下列问题:
![]()
(1)若B、C为氧化物,B转化为C时,质量增加25%,C能够与水反应生成一种强酸,则B
转化为C的化学方程式是_______________________;
(2)若D为某金属单质,向C的溶液中滴加硝酸银溶液,产生不溶于稀硝酸的白色沉淀,则B 的化学式是_____________;
(3)若D为强电解质溶液,A和C在溶液中反应生成白色沉淀B,则A和C反应的离子方程式是___________________符合条件的D物质可能是___________(填序号)。
①硫酸 ②醋酸 ③氢氧化钠 ④一水合氨 ⑤氯化钡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】废弃物的综合利用既有利于节约资源,又有利于保护环境。实验室利用废旧电池的铜帽(Cu、Zn 总含量约为99%)回收Cu并制备ZnO 的部分实验过程如下:

(1)写出铜帽溶解时铜与加入的稀硫酸、30%H2O2反应的离子反应方程式: ;铜帽溶解完全后,需加热(至沸)将溶液中过量的H2O2除去。
(2)为确定加入锌灰(主要成分为Zn、ZnO,杂质为铁及其氧化物)的量,实验中需测定除去H2O2 后溶液中Cu2+的含量。实验操作为:准确量取一定体积的含有Cu2+的溶液于带塞锥形瓶中,加适量水稀释,调节溶液pH=3~4,加入过量的KI,用Na2S2O3标准溶液滴定至终点。上述过程中反应的离子方程式如下:
2Cu2++4I-=2CuI(白色)↓+I2 2S2O32-+I2=2I-+S4O62-
①滴定选用的指示剂为 ,滴定终点观察到的现象为 ;
②某同学称取1.0g电池铜帽进行实验,得到100.00mL含有Cu2+的溶液,量取20.00mL上述含有Cu2+的溶液于带塞锥形瓶中,加适量水稀释,调节溶液pH=3~4,加入过量的KI,用0.1000mol/L Na2S2O3标准溶液滴定至终点。再重复操作实验3次,记录数据如下:
实验编号 | 1 | 2 | 3[ | 4 |
V(Na2S2O3)(mL) | 28.32 | 25.31 | 25.30 | 25.32 |
计算电池铜帽中Cu的质量分数为 ,(结果保留四位有效数字)若滴定前溶液中的H2O2没有除尽,则所测定c (Cu2+)将会 (填“偏高”、“偏低”或“无影响”);
(3)常温下,若向50mL 0.0001mol/L CuSO4溶液中加入50mL0.00022mol/LNaOH溶液,生成了沉淀。已知KSP[Cu (OH)2] =2.0×10-20(mol/L)3,计算沉淀生成后溶液中c(Cu2+)= mol/L;
(4)已知pH>11 时Zn(OH)2 能溶于NaOH溶液生成[Zn(OH)4]2-。下表列出了几种离子生成氢氧化物沉淀的pH(开始沉淀的pH 按金属离子浓度为1.0 mol·L-1计算)。
开始沉淀的pH | 沉淀完全的pH | |
Fe3+ | 1.1 | 3.2 |
Fe2+ | 5.8 | 8.8 |
Zn2+ | 5.9 | 8.9 |
实验中可选用的试剂:30%H2O2、1.0 mol·L-1HNO3、1.0 mol·L-1NaOH。由除去铜的滤液制备ZnO的实验步骤依次为:①向滤液中加入适量30% H2O2,使其充分反应;
② ;③过滤;
④ ;⑤过滤、洗涤、干燥;⑥900℃煅烧。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com