
【题目】标准状况下有以下四种气体:①6.72 L CH4 ②3.01×1023个HCl分子 ③13.6 g H2S ④0.2 mol NH3。下列关系不正确的是( )
A.体积:④<①<③<② B.质量:④<①<③<②
C.物质的量:①<②<③<④ D.氢原子数:②<④<③<①
【答案】C
【解析】
试题分析:①6.72L CH4的物质的量为![]() =0.3mol,②3.01×1023 个HCl分子的物质的量为
=0.3mol,②3.01×1023 个HCl分子的物质的量为![]() =0.5mol,③13.6g H2S的物质的量为
=0.5mol,③13.6g H2S的物质的量为![]() =0.4mol,④0.2mol NH3。A.根据V=nVm知,相同条件下体积之比等于物质的量之比,故体积④<①<③<②,故A正确;B.甲烷质量为0.3mol×16g/mol=4.8g,HCl的质量为0.5mol×36.5g/mol=33.25g,H2S的质量为0.4mol×34g/mol=13.6g,氨气的质量为0.2mol×17g/mol=3.4g,故质量④<①<③<②,故B正确;C.由上述计算可知,物质的量为④<①<③<②,故C错误;D.甲烷中n(H)=0.3mol×4=1.2mol,HCl中n(H)=0.5mol,硫化氢中n(H)=0.4mol×2=0.8mol,氨气中n(H)=0.2mol×3=0.6mol,故H原子数目②<④<③<①,故D正确。
=0.4mol,④0.2mol NH3。A.根据V=nVm知,相同条件下体积之比等于物质的量之比,故体积④<①<③<②,故A正确;B.甲烷质量为0.3mol×16g/mol=4.8g,HCl的质量为0.5mol×36.5g/mol=33.25g,H2S的质量为0.4mol×34g/mol=13.6g,氨气的质量为0.2mol×17g/mol=3.4g,故质量④<①<③<②,故B正确;C.由上述计算可知,物质的量为④<①<③<②,故C错误;D.甲烷中n(H)=0.3mol×4=1.2mol,HCl中n(H)=0.5mol,硫化氢中n(H)=0.4mol×2=0.8mol,氨气中n(H)=0.2mol×3=0.6mol,故H原子数目②<④<③<①,故D正确。


 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案科目:高中化学 来源: 题型:
【题目】将CO2应用于生产清洁燃料甲醇,既能缓解温室效应的影响,又能为能源的制备开辟新的渠道,其合成反应为CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)。回答下列问题:
CH3OH(g)+H2O(g)。回答下列问题:
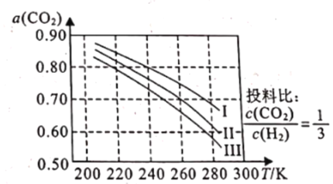
(1)如图为CO2平衡转化率和温度、压强的关系,其中压强分别为3.0MPa、4.0MPa和5.0MPa。据图可知,该反应为_______________反应(填“放热”或“吸热")。设CO2的初始浓度为comolL-1,根据5.0MPa时的数据计算该反应的平衡常数K(240k)=_______________ (列出计算式即可)。若在4.0MPa时减小投料比,则CO2的平衡转化率曲线可能位于II线的_______________(填“上方”或“下方”)。
(2)利用二氧化碳制得的甲醇还可以制取甲胺,其反应原理为CH3OH(g)+NH3(g)![]() CH3NH2(g)+H2O(g)△H。已知该反应中相关化学键的键能数据如下:
CH3NH2(g)+H2O(g)△H。已知该反应中相关化学键的键能数据如下:
共价键 | C—O | H—O | N—H | C—N |
键能/k.Jmol-1 | 351 | 463 | 393 | 293 |
则该反应的△H=_______________k.Jmol-1 。
(3)已知:①CO(g)+NO2(g)![]() CO2(g)+NO(g) △H1=-226kJrnol-1
CO2(g)+NO(g) △H1=-226kJrnol-1
②N2(g)+2O2(g)![]() 2NO2(g)△H2=+68kJmol-1
2NO2(g)△H2=+68kJmol-1
③N2(g)+O2(g)![]() 2NO(g) △H3=+183kJmol-1
2NO(g) △H3=+183kJmol-1
则:2CO(g)+2NO(g)![]() 2CO2(g)+N2(g) △H=_______________kJmol-1。
2CO2(g)+N2(g) △H=_______________kJmol-1。
(4)一定温度下,下列措施一定能加快反应CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)的速率的是_______________(填选项字母)。
CH3OH(g)+H2O(g)的速率的是_______________(填选项字母)。
A.及时移去甲醇 B.改进催化剂 C.提高反应物浓度 D.增大容器压强
(5)甲烷重整可选氧化物NiO- Al2O3作为催化剂,工业上常用Ni(NO3)2、Al(NO3)3混合液加入氨水调节pH=12(常温),然后将浊液高压恒温放置及煅烧等操作制备该催化剂。加入氨水调节pH=12时,c(Ni2+)为_______________。[已知:Ksp[Ni(OH)2]=5×10-16]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。某课外小组测定该补血剂中铁元素的含量。实验步骤如下:请回答下列问题:
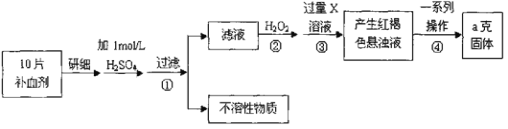
(1)实验中碾碎药片需要的仪器是_____________。
A.烧杯 B.研钵 C.坩埚
(2)证明步骤①滤液中含有Fe2+的方法是先滴加KSCN溶液,再滴加____________,该过程的现象为:__________________________________________________________。
(3)步骤②加入过量H2O2的目的:________________________________________。
(4)步骤②③中反应的离子方程式:②________________、③_________________。
(5)步骤④中一系列处理的操作步骤:过滤、___、灼烧、____、称量。
(6)若实验无损耗,则每片补血剂含铁元素的质量_____________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列说法中不正确的是( )
A.1molNH4+所含电子数为10NA
B..5.6LCO2中含有的分子数为0.25NA
C.1.2gMg与足量稀硫酸反应,转移的电子数为0.1NA
D.常温常压下,32gO2和O3的混合气体所含原子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.咖啡酸(如图),存在于许多中药中,如野胡萝卜、光叶水苏、荞麦、木半夏等。咖啡酸有止血作用,特别对内脏的止血效果较好。
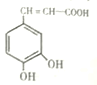
(1)咖啡酸与![]() 溶液反应的方程式为_______。
溶液反应的方程式为_______。
(2)蜂胶的主要活性成分为CPAE,分子式为![]() ,该物质在一定条件下可水解生成咖啡酸和一种醇,该醇为芳香醇且分子结构中无甲基,此芳香醇的结构简式为_____。
,该物质在一定条件下可水解生成咖啡酸和一种醇,该醇为芳香醇且分子结构中无甲基,此芳香醇的结构简式为_____。
II.已知A的结构简式为:![]()
(1)写出A与NaOH溶液共热的化学方程式:______。
(2)A的同分异构体Ⅰ和J是重要的医药中间体,在浓硫酸的作用下,Ⅰ和J分别生成![]() 和
和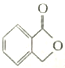 ,鉴别Ⅰ和J的试剂为_______________。
,鉴别Ⅰ和J的试剂为_______________。
(3)A的另一种同分异构体K用于合成高分子材料,K可由![]() 制得,写出K在浓硫酸作用下生成的聚合物的结构简式:_______________
制得,写出K在浓硫酸作用下生成的聚合物的结构简式:_______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硝酸是重要的化工原料,也是化学实验室里必备的重要试剂。除了具有酸的通性以外,还具有一些特殊的性质。
Ⅰ.镁与稀硝酸的反应为:4Mg+10HNO3(稀)=4Mg(NO3)2+NH4NO3+3H2O
(1)用“双线桥法”表示该反应中电子转移的方向和数目___。
(2)该反应中氧化剂与还原剂的物质的量之比为___。
(3)还原产物是__。
(4)若反应过程中转移的电子数为1.505×1023,则参加反应的Mg的质量为__。
Ⅱ.某一反应体系中有反应物和生成物共5种物质:S、H2S、HNO3、NO、H2O。已知水是反应的产物之一。写出反应的化学方程式__(不必配平)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国尿素合成塔(尿塔)使用寿命仅为欧美国家的1/4。为此北京钢铁研究院对某尿塔腐蚀过程进行研究,得出下列腐蚀机理:
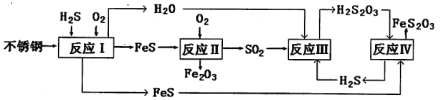
(1)H2S来自合成尿素的天然气。在380K、体积为2L的密闭容器中,存在反应:H2(g)+S(s)![]() H2S(g) △H=+21.6 kJ·mol-1。反应达到平衡时,H2、S、H2S的物质的量均为3 mol。
H2S(g) △H=+21.6 kJ·mol-1。反应达到平衡时,H2、S、H2S的物质的量均为3 mol。
①380K时该反应的化学平衡常数为__________。
②下列对该反应分析正确的是_________(填序号)。
(2)反应II的化学方程式为:____________________________________。
(3)已知室温下H2S2O3:K1=2.2×10-1,K2=2.5×10-2。
①Na2S2O3水溶液中电荷守恒式为___________________________;
②反应IV的化学方程式_____________________________________。该反应_________(填“能”或“不能”)说明FeS溶解性强于FeS2O3。
(4)此尿塔的最终腐蚀产物为__________________。为了有效防腐,北钢建议该尿塔在生产中用CuSO4溶液“脱硫(H2S)”,离子反应方程式为_________。(室温下,H2S:K1=1.3×10-7、K2=7.1×10-15。CuS:Ksp=6.3×10-36)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同温同压下,等体积的一氧化二氮(N2O)和二氧化碳两种气体相比较:①质量相等、②所含碳原子数与氮原子数相等、③所含分子数相等。上述结论中正确的是( )
A. ①②③ B. ②③ C. ①② D. ①③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国科学院科研团队研究表明,在常温常压和可见光下,基于LDH(一种固体催化剂)合成NH3的原理示意图。下列说法不正确的是

A.该过程中H2O被还原生成氧气
B.该过程中涉及极性键和非极性键的断裂与生成
C.基于合成NH3的过程属于氮的固定
D.该过程的化学方程式为:2N2+6H2O![]() 4NH3+3O2
4NH3+3O2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com