
【题目】下列实验装置的相关描述不正确的是
A.![]() 可用于叶绿体中色素的分离
可用于叶绿体中色素的分离
B. 可用于过滤颗粒很小的沉淀,不宜于过滤胶状沉淀
可用于过滤颗粒很小的沉淀,不宜于过滤胶状沉淀
C.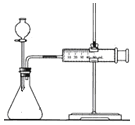 可用于某些化学反应速率的测定。该装置气密性的检查如下:仪器组装好后,关闭分液漏斗活塞,将针筒活塞向外拉一段距离,然后松手,观察针筒是否能回到原来刻度处
可用于某些化学反应速率的测定。该装置气密性的检查如下:仪器组装好后,关闭分液漏斗活塞,将针筒活塞向外拉一段距离,然后松手,观察针筒是否能回到原来刻度处
D.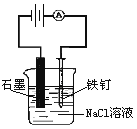 不可用来模拟氯碱工业
不可用来模拟氯碱工业
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】海水的综合利用一直是研究课题。某地天然海水(主要含Na+、K+、Ca2+、Mg2+、Cl-、SO42-、Br-、CO32-、HCO3-等离子),研究用海水吸收燃煤排放的含有SO2烟气的工艺流程如图所示,下列说法中正确的是
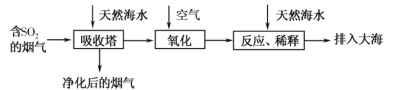
A.工艺中天然海水显酸性
B.氧化过程中可能发生的离子反应为2SO2+2H2O+O2=4H++2SO42-
C.排入大海的溶液与天然海水相比,只有SO42-数量发生了变化
D.若将氧化后的液体进行蒸发结晶,得到的晶体中CaSO4含量最高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解原理和原电池原理是电化的两个重要内容。某兴趣小组做如下探究实验:
(1)如图为某实验小组依据氧化还原反应设计的原电池装置,该反应的离子方程式为_____________。反应前,电极质量相等,一段时间后,两电极质量相差12g,导线中通过_______mol电子。

(2)其他条件不变,若将CuCl2溶液换为NH4Cl溶液,石墨电极的反应式为________________。
(3)如图,其他条件不变,若将盐桥换成弯铜导线与石墨相连成n型,乙装置中石墨(2)电极上发生的反应式为_________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属铝在现代生产和日常生活中应用广泛。
(1)工业上用电解熔融氧化铝的方法来制取金属铝。
①金属铝在_______(填电极名称)生成。
②电解过程中作阳极的石墨易消耗,原因是_______。
(2)英国《自然》杂志近期报道了一种新型可充铝离子电池,以金属铝和石墨为电极,用AlCl4—和有机阳离子构成电解质溶液,其放电工作原理如图所示。
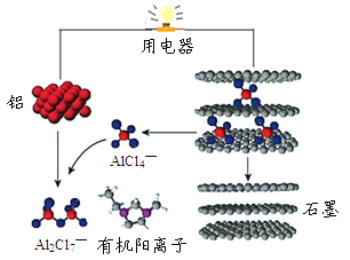
①电池放电时负极的电极反应式为_____。
②充电时有机阳离子向________电极移动(填“铝”或“石墨”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列不能用勒夏特列原理解释的事实是
A. 红棕色的NO2加压后颜色先变深后变浅
B. 氢气、碘蒸气、碘化氢气体组成的平衡体系加压后颜色变深
C. 黄绿色的氯水光照后颜色变浅
D. 合成氨工业使用高压以提高氨的产量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室按如下装置测定纯碱(含少量 NaCl)的纯度。下列说法错误的是
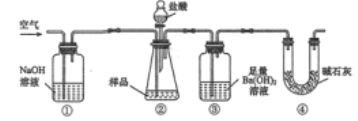
A. 实验前, 应进行气密性检查
B. 必须在装置②、 ③间添加吸收 HCl 气体的装置
C. 装置④的作用是防止空气中的 CO2进入装置③与 Ba(OH)2 溶液反应
D. 反应结束时,应再通入空气将装置②中产生的气体完全转移到装置③中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】污染物的有效去除和资源的充分利用是化学造福人类的重要研究课题。某研究小组利用软锰矿(主要成分为MnO2,另含少量铁,铝,铜等金属化合物)作脱硫剂,通过如下简化流程,既脱除燃煤尾气中的SO2,又制得电池材料MnO2(反应条件已省略)。

请回答下列问题:
(1)上述流程脱硫实现了________(选填编号)。
a.废弃物的综合利用 b.白色污染的减少 c.酸雨的减少 d.臭氧层空洞的减少
(2)步骤I生成无水MnSO4的化学方程式是________。步骤IV生成无水MnO2的化学方程式是________。
(3)步骤I中,用MnCO3能除去溶液中Al3+和Fe3+,其原因是_______。滤渣M的成分是________。铜元素以________形式存在于滤渣N中。(写化学式)
(4)产品MnO2可作超级电容材料,用惰性电极电解MnSO4溶液可以制得MnO2,则MnO2在________生成。(填电极名称)
(5)假设脱除的SO2只与软锰矿浆中MnO2反应。按照图示流程,将2.0m3(标准状况)含SO2的体积分数为60%的尾气通入矿浆,若SO2的脱除率为89.6%,最终得到MnO2的质量10.44kg。则在除去铁、铝、铜、镍等杂质的过程中,所引入的锰元素为________kg。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】固体D是一种红色氧化物。

(1)混合气体A通入足量NaOH溶液后,溶液B中属于盐的溶质有___________________。
(2)白色沉淀C中加入盐酸的实验现象为____________________________________。
(3)固体D与HCl溶液反应的离子方程式为______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)t1℃时,密闭容器中,通入一定量的CO和H2O,发生如下反应:CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH<0。容器中各物质浓度(单位:mol·L-1)变化如下表所示:
CO2(g)+H2(g) ΔH<0。容器中各物质浓度(单位:mol·L-1)变化如下表所示:
时间(min) | CO | H2O | CO2 | H2 |
0 | 0.200 | 0.300 | 0 | 0 |
2 | 0.138 | 0.238 | 0.062 | 0.062 |
3 | c1 | c2 | c3 | c3 |
4 | c1 | c2 | c3 | c3 |
5 | 0.116 | 0.216 | 0.084 | |
6 | 0.096 | 0.266 | 0.104 |
①一定处于平衡状态的时间段为___。
②5~6min时间段内,平衡移动方向为___(填“向左移动”或“向右移动”),根据表中数据判断,平衡移动的原因是___(填字母编号)。
a.增加了H2O(g)的量 b.增加氢气浓度
c.使用催化剂 d.降低温度
③t2℃时(t2>t1),在相同条件下发生上述反应,达平衡时,CO浓度___c1(填“>”“<”或“=”)。
(2)已知反应Fe(s)+CO2(g)![]() FeO(s)+CO(g)的平衡常数随温度变化情况如图1所示:
FeO(s)+CO(g)的平衡常数随温度变化情况如图1所示:
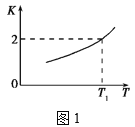
①用CO还原FeO制备Fe的反应是___(填“吸热”或“放热”)反应。
②温度为T2时,实验测得该反应体系中CO浓度为CO2的2.5倍,则T2___T1(填“>”“<”或“=”)。
(3)工业上常用CO、CO2和H2合成甲醇燃料,其原理为:
①CO(g)+2H2(g)![]() CH3OH(g) ΔH<0
CH3OH(g) ΔH<0
②CO2(g)+H2(g)![]() CO(g)+H2O(g) ΔH>0
CO(g)+H2O(g) ΔH>0
当混合气体的组成固定时,CO平衡转化率(α)与温度和压强的关系如图2所示。
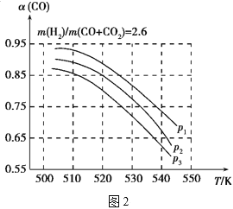
图中的压强由大到小的顺序为___,判断理由是___;试解释CO平衡转化率随温度升高而减小的原因是___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com