
【题目】(1)t1℃时,密闭容器中,通入一定量的CO和H2O,发生如下反应:CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH<0。容器中各物质浓度(单位:mol·L-1)变化如下表所示:
CO2(g)+H2(g) ΔH<0。容器中各物质浓度(单位:mol·L-1)变化如下表所示:
时间(min) | CO | H2O | CO2 | H2 |
0 | 0.200 | 0.300 | 0 | 0 |
2 | 0.138 | 0.238 | 0.062 | 0.062 |
3 | c1 | c2 | c3 | c3 |
4 | c1 | c2 | c3 | c3 |
5 | 0.116 | 0.216 | 0.084 | |
6 | 0.096 | 0.266 | 0.104 |
①一定处于平衡状态的时间段为___。
②5~6min时间段内,平衡移动方向为___(填“向左移动”或“向右移动”),根据表中数据判断,平衡移动的原因是___(填字母编号)。
a.增加了H2O(g)的量 b.增加氢气浓度
c.使用催化剂 d.降低温度
③t2℃时(t2>t1),在相同条件下发生上述反应,达平衡时,CO浓度___c1(填“>”“<”或“=”)。
(2)已知反应Fe(s)+CO2(g)![]() FeO(s)+CO(g)的平衡常数随温度变化情况如图1所示:
FeO(s)+CO(g)的平衡常数随温度变化情况如图1所示:
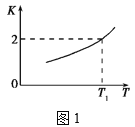
①用CO还原FeO制备Fe的反应是___(填“吸热”或“放热”)反应。
②温度为T2时,实验测得该反应体系中CO浓度为CO2的2.5倍,则T2___T1(填“>”“<”或“=”)。
(3)工业上常用CO、CO2和H2合成甲醇燃料,其原理为:
①CO(g)+2H2(g)![]() CH3OH(g) ΔH<0
CH3OH(g) ΔH<0
②CO2(g)+H2(g)![]() CO(g)+H2O(g) ΔH>0
CO(g)+H2O(g) ΔH>0
当混合气体的组成固定时,CO平衡转化率(α)与温度和压强的关系如图2所示。
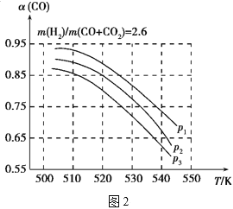
图中的压强由大到小的顺序为___,判断理由是___;试解释CO平衡转化率随温度升高而减小的原因是___。
【答案】3~4 min 向右移动 a > 放热 > p1>p2>p3 相同温度下,由于反应①为气体分子数减小的反应,加压平衡正向移动,CO转化率增大,而反应②为气体分子数不变的反应,产生CO的量不受压强影响,故增大压强时,有利于提高CO的转化率 反应①为放热反应,升高温度,平衡逆向移动,使得体系中CO的量增大,反应②为吸热反应,升高温度时,平衡正向移动,产生CO的量增大,总结果就是随温度升高,CO的转化率减小
【解析】
⑴①从表格中数据分析,体系中各物质的浓度不再变化的时间就为达到平衡状态;根据数据看出H2O(g)的浓度增大,CO的浓度减小,说明是增加了H2O(g)的量;反应的正反应为放热反应,升高温度,平衡逆向移动,CO转化率减小。
⑵升高温度,化学平衡常数增大,正反应为吸热反应,则其逆反应为放热反应,计算T2的K值,与T1的K值比较,得出温度关系。
⑶由于反应①为气体分子数减小的反应,加压平衡正向移动,CO转化率增大,而反应②为气体分子数不变的反应,产生CO的量不受压强影响,故增大压强时,有利于提高CO的转化;反应①为放热反应,升高温度,平衡逆向移动,使得体系中CO的量增大,反应②为吸热反应,升高温度时,平衡正向移动,产生CO的量增大,总结果就是随温度升高,CO的转化率减小。
⑴①从表格中数据分析,第3~4 min时,体系中各物质的浓度不再变化,说明反应已经达到平衡状态,故答案为:3~4 min。
②5~6min时间段内,H2O(g)的浓度增大,CO的浓度减小,说明是增加了H2O(g)的量,使平衡正向移动,故答案为:向右移动;a。
③该反应的正反应为放热反应,升高温度,平衡逆向移动,CO转化率减小,则t2℃反应达到平衡时,CO浓度 > c1,故答案为:>。
⑵①由题图1可知,升高温度,化学平衡常数增大,说明Fe(s)+CO2(g)![]() FeO(s)+CO(g)为吸热反应,则其逆反应为放热反应,故答案为:放热。
FeO(s)+CO(g)为吸热反应,则其逆反应为放热反应,故答案为:放热。
②K(T2)=c(CO)/c(CO2)=2.5 > K(T1),根据图像信息可知,K越大,对应的温度越高,所以T2>T1,故答案为:>。
⑶反应①是体积减小的反应,反应②是等体积反应,从上到下,转化率增长,说明是增大压强,因此压强由大到小的顺序为p1>p2>p3,判断理由是相同温度下,由于反应①为气体分子数减小的反应,加压平衡正向移动,CO转化率增大,而反应②为气体分子数不变的反应,产生CO的量不受压强影响,故增大压强时,有利于提高CO的转化率,CO平衡转化率随温度升高而减小的原因应①为放热反应,升高温度,平衡逆向移动,使得体系中CO的量增大,反应②为吸热反应,升高温度时,平衡正向移动,产生CO的量增大,总结果就是随温度升高,CO的转化率减小,故答案为:p1>p2>p3;相同温度下,由于反应①为气体分子数减小的反应,加压平衡正向移动,CO转化率增大,而反应②为气体分子数不变的反应,产生CO的量不受压强影响,故增大压强时,有利于提高CO的转化率;反应①为放热反应,升高温度,平衡逆向移动,使得体系中CO的量增大,反应②为吸热反应,升高温度时,平衡正向移动,产生CO的量增大,总结果就是随温度升高,CO的转化率减小。


科目:高中化学 来源: 题型:
【题目】下列实验装置的相关描述不正确的是
A.![]() 可用于叶绿体中色素的分离
可用于叶绿体中色素的分离
B. 可用于过滤颗粒很小的沉淀,不宜于过滤胶状沉淀
可用于过滤颗粒很小的沉淀,不宜于过滤胶状沉淀
C.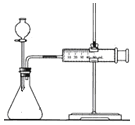 可用于某些化学反应速率的测定。该装置气密性的检查如下:仪器组装好后,关闭分液漏斗活塞,将针筒活塞向外拉一段距离,然后松手,观察针筒是否能回到原来刻度处
可用于某些化学反应速率的测定。该装置气密性的检查如下:仪器组装好后,关闭分液漏斗活塞,将针筒活塞向外拉一段距离,然后松手,观察针筒是否能回到原来刻度处
D.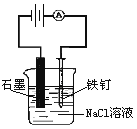 不可用来模拟氯碱工业
不可用来模拟氯碱工业
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将H2S转化为可再利用的资源是能源研究领域的重要课题。某转化工作原理如图。该装置工作时,下列叙述错误的是( )
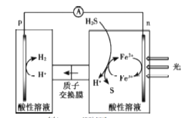
A.p电极的电极反应:2H++2e-=H2
B.该方法能实现由H2S高效产生S和H2
C.光照后,n电极的电极反应:H2S-2e-=2H++S
D.除了Fe3+/Fe2+外,I3-/I-也能实现如图所示循环
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在①CO2,②NaCl,③Na,④Si,⑤CS2,⑥金刚石,⑦(NH4)2SO4,⑧乙醇中,由极性键形成的非极性分子有_______(填序号,以下同),含有金属离子的物质是__,分子间可形成氢键的物质是________,属于离子晶体的是__,属于原子晶体的是__,①~⑤五种物质的熔点由高到低的顺序是__。
(2)A,B,C,D为四种晶体,性质如下:
A.固态时能导电,能溶于盐酸
B.能溶于CS2,不溶于水
C.固态时不导电,液态时能导电,可溶于水
D.固态、液态时均不导电,熔点为3500 ℃
试推断它们的晶体类型:A.__;B.__;C.__;D.__。
(3)下图中A~D是中学化学教科书上常见的几种晶体结构模型,请填写相应物质的名称:A.__;B.__;C.__D.____。
.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】己烯雌酚是一种激素类药物,其结构简式如图所示。下列有关叙述中不正确的是( )
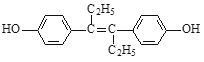
A. 己烯雌酚的分子式为C18H20O2
B. 己烯雌酚分子中一定有16个碳原子共平面
C. 己烯雌酚为芳香族化合物
D. 己烯雌酚可发生加成、取代、氧化、加聚、酯化、硝化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 乳酸薄荷醇酯(![]() )仅能发生水解、氧化、消去反应
)仅能发生水解、氧化、消去反应
B. 乙醛和丙烯醛(![]() )不是同系物,它们与氢气充分反应后的产物也不是同系物
)不是同系物,它们与氢气充分反应后的产物也不是同系物
C. 淀粉和纤维素在酸催化下完全水解后的产物都是葡萄糖
D. CH3COOCH2CH3与CH3CH2COOCH3互为同分异构体,1H-NMR谱显示两者均有三种不同的氢原子且三种氢原子的比例相同,故不能用1H-NMR来鉴别
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图示为一种天然产物,具有一定的除草功效,下列有关该化合物的说法错误的是( )

A.分子中含有三种含氧官能团
B.1mol该化合物最多能与6molNaOH反应
C.既可以发生取代反应,又能够发生加成反应
D.能与FeCl3发生显色反应,不能和NaHCO3反应放出CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 是一种常用的还原剂、媒染剂。某化学小组同学在实验室里用如下两种方法来制备无水
是一种常用的还原剂、媒染剂。某化学小组同学在实验室里用如下两种方法来制备无水![]() 。有关物质的性质如下:
。有关物质的性质如下:
|
|
|
| |
溶解性 | 不溶于水,易溶于苯、乙醇 | 不溶于 | ||
熔点 |
| 53 | 易升华 | |
沸点 | 132 | 173 |
|
|
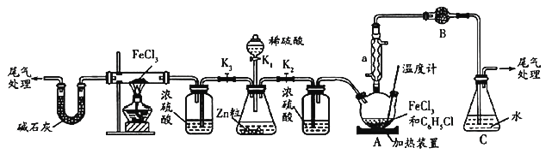
请回答下列问题:
(1)利用反应![]() 制取无水
制取无水![]() 并测定
并测定![]() 的转化率。按上图装置,在三颈烧瓶中放入
的转化率。按上图装置,在三颈烧瓶中放入![]() 无水氯化铁和过量的氯苯。打开
无水氯化铁和过量的氯苯。打开![]() 、
、![]() ,关闭
,关闭![]() ,通一段时间
,通一段时间![]() 后关闭
后关闭![]() ,控制三颈烧瓶内反应温度在
,控制三颈烧瓶内反应温度在![]() ,反应一段时间。反应完成后打开
,反应一段时间。反应完成后打开![]() 再通氢气一段时间。
再通氢气一段时间。
①仪器a的名称是_________,装置B中盛装的试剂是____________。
②反应后再通入![]() 的目的是________。
的目的是________。
③冷却实验装置,将三颈烧瓶内物质倒出,经过滤、用苯洗涤、干燥后,得到粗产品,回收滤液中![]() 的操作方法是________。
的操作方法是________。
(2)打开![]() 、
、![]() ,关闭
,关闭![]() ,通氢气与氯化铁反应制取无水
,通氢气与氯化铁反应制取无水![]() 。
。
①写出反应的化学方程式_____________。
②实验制得![]() 后并防止氧化的操作是_______。
后并防止氧化的操作是_______。
③请指出该制备方法的缺点________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应可实现燃煤烟气中硫的回收:SO2(g)+2CO(g) ![]() 2CO2(g)+S(l) ΔH<0,若反应在恒容的密闭容器中进行,下列有关说法正确的是( )
2CO2(g)+S(l) ΔH<0,若反应在恒容的密闭容器中进行,下列有关说法正确的是( )
A.平衡时,其他条件不变,升高温度可提高 SO2 的转化率
B.其他条件不变,缩小容器体积,平衡正反应方向移动,该反应的平衡常数不变
C.平衡前,充入氩气,容器内压强增大,反应速率加快
D.平衡时,其他条件不变,分离出硫,逆反应速率减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com