
【题目】将4 g NaOH溶解于水配成1L溶液,从中取出10mL,这10mL溶液的物质的量浓度是( )
A.1 mol/L
B.0.1 mol/L
C.0.01 mol/L
D.10 mol/L
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】一定条件下,H2O2在水溶液中发生分解反应:2H2O2 ![]() 2H2O+O2↑
2H2O+O2↑
反应过程中,测得不同时间H2O2的物质的量浓度如表:
t/min | 0 | 20 | 40 | 60 | 80 |
c(H2O2)/molL﹣1 | 0.80 | 0.40 | 0.20 | 0.10 | 0.05 |
(1)H2O2的分解反应氧化还原反应(填“是”或“不是”).要加快该反应的速率,可采取的方法有 .
(2)该分解反应0─20min的平均反应速率v(H2O2)为molL﹣1 min﹣1 .
(3)如果反应所用的H2O2溶液为100mL,则共产生O2g.
A.0.08
B.0.16
C.1.2
D.2.4.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中草药秦皮中含有七叶树内酯,其结构简式为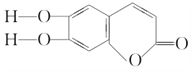 ,具有抗菌作用。若1 mol七叶树内酯分别与浓溴水和NaOH溶液完全反应,则消耗Br2和NaOH的物质的量分别为( )
,具有抗菌作用。若1 mol七叶树内酯分别与浓溴水和NaOH溶液完全反应,则消耗Br2和NaOH的物质的量分别为( )
A. 3 mol、2 mol B. 3 mol、3 mol C. 2 mol、2 mol D. 3 mol、4 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛(Ti)被誉为21世纪金属。冶炼钛的主要原料是含Fe2O3的钛铁矿(FeTiO3),其生产过
程如图:

已知:TiOSO4可溶于水且易水解,H2TiO3难溶于水。试回答下列问题:
(1)步骤②的主要实验操作是冷却、结晶、_________(填操作名称);步骤④在实验室中常将试剂置于___________(填仪器名称)中加强热。
(2)步骤③中加入热水的作用是__________________________________。
(3)步骤④中硫酸亚铁晶体(FeSO47H2O)在空气中煅烧生成铁红、水和三氧化硫,写出该反应的化学方程式______________________________________________________________。
(4)步骤②所得到的硫酸亚铁晶体(FeSO47H2O)是目前工业上处理含铬有毒废水常用的化学试剂,二者反应后(Cr由+6价转化为+3价)可以转化为有重要工业价值的铁氧体复合氧化物(常用FeOFeyCrxO3表示)。欲制备该铁氧体复合氧化物,试求在酸性的含铬废水中,加入FeSO47H2O的物质的量应为废水中六价铬(相当于CrO3)的物质的量的__________倍。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用铝土矿(主要成分为Al2O3 , 还有少量Fe2O3、SiO2等杂质)提取氧化铝作冶炼铝的原料,提取的操作过程如图所示: 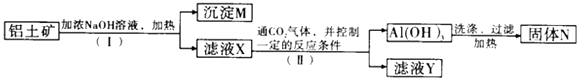
(1)Ⅰ和Ⅱ步骤中分离滤液和沉淀的操作是 .
(2)沉淀M中除含有泥沙外,一定还含有;固体N是 .
(3)滤液X中,含铝元素的溶质的化学式为;它属于(填“酸”“碱”或“盐”)类物质.
(4)实验室里常往AlCl3溶液中加入(填“氨水”或“NaOH溶液”)来制取Al(OH)3 . 发生反应的离子方程式为
(5)向滤液Y中滴加足量盐酸,发生的离子反应方程式为(若没有反应发生,则填“无”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.铜、石墨均能导电,所以它们均是电解质
B.NH3、CO2的水溶液均能导电,所以NH3、CO2均是电解质
C.将25gCuSO4.5H2O晶体加水配成100mL溶液,该溶液的物质的量浓度为1mol/L
D.实验室要用容量瓶配制0.2mol/L的NaCl溶液950mL,应称量NaCl固体11.1g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】《茉莉花》是一首脍炙人口的江苏民歌。茉莉花香气的成分有多种,乙酸苯甲酯(![]() )是其中的一种,它可以从茉莉花中提取,也可以用甲苯和乙醇为原料进行人工合成。一种合成路线如下:
)是其中的一种,它可以从茉莉花中提取,也可以用甲苯和乙醇为原料进行人工合成。一种合成路线如下:

(1)写出反应②的化学方程式:_____________________________。
(2)反应③的反应类型为____________。
(3)C的结构简式为____________。
(4)C通常有三种不同类别的芳香族同分异构体,试写出另两种不同类别的同分异构体的结构简式(各写一种)____________、____________。
(5)反应________(填序号)原子的理论利用率为100%,符合绿色化学的要求。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】砷化镓(GaAs)是优良的半导体材料,可用于制作微型激光器或太阳能电池的材料等。回答下列问题:
(1)写出基态As原子的核外电子排布式________________________。
(2)根据元素周期律,原子半径Ga_____________As,第一电离能Ga____________As。(填“大于”或“小于”)
(3)AsCl3分子的立体构型为____________________,其中As的杂化轨道类型为_________。
(4)GaF3的熔点高于1000℃,GaCl3的熔点为77.9℃,其原因是_____________________。
(5)GaAs的熔点为1238℃,密度为ρg·cm-3,其晶胞结构如图所示。该晶体的类型为________________,Ga与As以________键键合。Ga和As的摩尔质量分别为MGa g·mol-1和MAs g·mol-1,原子半径分别为rGa pm和rAs pm,阿伏伽德罗常数值为NA,则GaAs晶胞中原子的体积占晶胞体积的百分率为____________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.二氧化硫能使紫色石蕊试液变红B.干燥的氯气能使pH试纸先变红后褪色
C.常温下,铁和浓硫酸会反应D.碳酸氢钠可与盐酸反应,故可作治疗胃酸过多的药剂
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com