
【题目】下列说法正确的是( )
A.铜、石墨均能导电,所以它们均是电解质
B.NH3、CO2的水溶液均能导电,所以NH3、CO2均是电解质
C.将25gCuSO4.5H2O晶体加水配成100mL溶液,该溶液的物质的量浓度为1mol/L
D.实验室要用容量瓶配制0.2mol/L的NaCl溶液950mL,应称量NaCl固体11.1g
【答案】C
【解析】解:A、铜、石墨属于单质,既不是电解质也不是非电解质,故A错误;
B、NH3、CO2的水溶液导电的原因是一水合氨、碳酸电离出的离子,不是NH3、CO2本身电离的离子,因此NH3、CO2属于非电解质,故B错误;
C、25g CuSO45H2O的物质的量为 ![]() =0.1mol,故n(CuSO4)=0.1mol,溶液体积为100mL,故该溶液中CuSO4的物质的量浓度为:
=0.1mol,故n(CuSO4)=0.1mol,溶液体积为100mL,故该溶液中CuSO4的物质的量浓度为: ![]() =1mol/L,故C正确;
=1mol/L,故C正确;
D、没有950ml的容量瓶,应选择1000ml容量瓶,配制0.2mol/L的NaCl溶液需氯化钠质量为1L×0.2mol/L×58.5g/mol=11.7g,故D错误,故选C.
【考点精析】解答此题的关键在于理解配制一定物质的量浓度的溶液的相关知识,掌握配制物质的量浓度溶液时,先用烧杯加蒸馏水至容量瓶刻度线1cm~2cm后,再改用交投滴管加水至刻度线.


科目:高中化学 来源: 题型:
【题目】工业上制取氯酸钾的主要步骤为:
I.将Cl2通入石灰浆,在75℃左右充分反应,然后过滤;
II.向滤液中加入稍过量的KCl固体,进行适当操作可析出KClO3固体。
请回答下列问题:
(1)步骤I中总反应的化学方程式为6Ca(OH)2+ 6Cl2=Ca(ClO3)2+5CaCl2+ 6H2O 。
①标出反应中电子转移的方向和数目______________。
②滤液中Ca(ClO3)2与CaC12的物质的量之比n[Ca(ClO3)2]:n [CaCl2]____l∶5 (填“> ”“< ”、或“=” ) ,理由是___________。
(2)下图是有关物质的溶解度曲线。步骤II中,若溶液中KClO3的含量为147g·L-1,则KClO3得物质的量浓度为_______________。从该溶液中尽可能多地析出KClO3 固体的方法是______________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】双酚A的结构简式如下图所示,下列有关此物质的说法正确的是( )

A. 1 mol该物质与足量溴水反应消耗2 mol Br2
B. 该物质能与碳酸氢钠溶液反应放出CO2
C. 该物质的所有碳原子可能在同一平面
D. 该物质与足量氢气发生加成反应后所得物质的化学式为C15H28O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能含有Na+、NH4+、Cl﹣、SO42﹣、NO3﹣、CO32﹣ , 现进行如下实验:
(I)取一定量的溶液于试管中,加入过量的Ba(NO3)2溶液有白色沉淀生成,过滤出的沉淀部分溶于稀HNO3 , 并放出5.6L(标况下)无色无味的气体,剩余沉淀4.66g.
(II)取部分滤液,加入过量的NaOH溶液并加热,产生13.6g无色有刺激性气味的气体,该气体能使湿润的红色石蕊试纸变蓝.
(III)另取部分滤液,加入AgNO3溶液,无明显现象.
根据以上现象,试判断:
①溶液中肯定存在的离子是 ;
②溶液中肯定不存在的离子是 ;
③溶液中可能存在的离子是 ;
④写出实验(I)中沉淀部分溶于稀HNO3并放出无色无味气体的离子方程式:
⑤实验(II)中产生气体的离子方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将4 g NaOH溶解于水配成1L溶液,从中取出10mL,这10mL溶液的物质的量浓度是( )
A.1 mol/L
B.0.1 mol/L
C.0.01 mol/L
D.10 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关金属腐蚀的叙述正确的是
A. 金属越纯越不易被腐蚀 B. 干燥环境下金属不被腐蚀
C. 铜一定比铁难腐蚀 D. 金属的腐蚀有化学腐蚀和电化学腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了保护环境,充分利用资源,某研究小组通过如下简化流程,将工业制硫酸的硫铁矿烧渣(铁主要以![]() 存在)转变成重要的工业原料
存在)转变成重要的工业原料![]() (反应条件略)
(反应条件略)
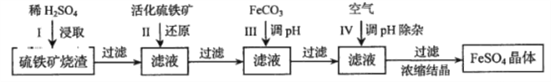
活化硫铁矿还原Fe2+的主要反应为:FeS2+7Fe2(SO4)3+8H2O=15FeSO4+8H2SO4,不考虑其他反应,请回答下列问题:
(1)第Ⅰ步H2SO4与Fe2O3反应的离子方程式是___________________________。
(2)检验第Ⅱ步中Fe3+是否完全还原,应选择(________)(填字母编号)。
A.KMnO4溶液 B.淀粉-KI溶液 C.KSCN溶液
(3)第Ⅲ步加FeCO3调溶液pH到5.8左右,然后再第VI步通入空气使溶液pH降到5.2,此时Fe2+不沉淀,滤液中铝、硅杂质除尽。通入空气引起溶液pH降低的原因是________________。
(4)FeSO4可转化为FeCO3,FeCO3在空气中加热反应可制得铁系氧化物材料。
已知25℃,101kPa时:
4Fe(s)+3O2(g)=2Fe2O3(s) ΔH=-1648kJ/mol
C(s)+O2(g)=CO2(g) ΔH=-393kJ/mol
2Fe(s)+2C(s)+3O2(g)=2FeCO3(s) ΔH=-1480kJ/mol
FeCO3在空气中加热反应生成Fe2O3的热化学方程式是______________。
(5)FeSO4在一定条件下可制得FeS2(二硫化亚铁)纳米材料。该材料可用于制造高容量锂电池,电池放电时的总反应为4Li+FeS2=Fe+2Li2S,正极反应式是________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法中正确的是
A. 1 mol FeI2与足量氯气反应时转移的电子数为2NA
B. 常温常压下,46gNO2和N2O4混合气体含有的原子数为3NA
C. 在过氧化钠与水的反应中,每生成0.1mol氧气,转移电子数为0.4 NA
D. 常温下56 g铁片投入足量浓H2SO4中生成NA个SO2分子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com