
【题目】硅单质及其化合物应用范围很广。请回答下列问题:
(1)制备硅半导体材料必须先得到高纯硅。三氯甲硅烷(SiHCl3)还原法是当前
制备高纯硅的主要方法,生产过程示意图如下:
![]()
写出由纯SiHCl3制备高纯硅的化学反应方程式_______________________________。整个制备过程必须严格控制无水无氧。SiHCl3遇水剧烈反应生成H2SiO3、HCl和另一种物质,写出配平的化学反应方程式______________________________________________。H2还原SiHCl3过程中若混入O2,可能引起的后果是____________________________________________。
(2)下列有关硅材料的说法正确的是________(填字母)。
A.碳化硅化学性质稳定,可用于生产耐高温水泥
B.氮化硅硬度大、熔点高,可用于制作高温陶瓷和轴承
C.高纯度的二氧化硅可用于制造高性能通讯材料——光导纤维
D.普通玻璃是由纯碱、石灰石和石英砂制成的,其熔点很高
E.盐酸可以与硅反应,故采用盐酸为抛光液抛光单晶硅
(3)硅酸钠水溶液俗称水玻璃。取少量硅酸钠溶液于试管中,逐滴加入饱和氯化铵溶液,振荡。写出实验现象并给予解释。____________________________________________。
【答案】SiHCl3+H2![]() Si+3HCl SiHCl3+3H2O=H2SiO3↓+3HCl↑+H2↑ 氧气与氢气混合,可能引起爆炸;氧气可能会氧化SiHCl3 BC 试管中有白色胶状沉淀生成,并且有刺激性气体生成Na2SiO3和NH4Cl均能够水解,二者相互促进,Na2SiO3水解生成H2SiO3,NH4Cl水解产生NH3
Si+3HCl SiHCl3+3H2O=H2SiO3↓+3HCl↑+H2↑ 氧气与氢气混合,可能引起爆炸;氧气可能会氧化SiHCl3 BC 试管中有白色胶状沉淀生成,并且有刺激性气体生成Na2SiO3和NH4Cl均能够水解,二者相互促进,Na2SiO3水解生成H2SiO3,NH4Cl水解产生NH3
【解析】
1)①氢气和纯SiHCl3反应生成高纯硅;
②SiHCl3遇水剧烈反应生成H2SiO3、HCl和氢气,氢气易爆炸;
(2)A.原子晶体熔点高,耐高温;
B.原子晶体熔点高硬度大;
C.二氧化硅具有折光性;
D.盐熔点较高;
E.硅与盐酸不反应;
(3)硅酸钠和稀硝酸反应生成不溶性的硅酸。
(1)①氢气和纯SiHCl3反应生成高纯硅和氯化氢:SiHCl3+H2
![]() Si+3HCl,故答案为:SiHCl3+H2
Si+3HCl,故答案为:SiHCl3+H2![]() Si+3HCl;
Si+3HCl;
②SiHCl3遇水剧烈反应生成H2SiO3、HCl和氢气:SiHCl3+3H2O═H2SiO3+H2↑+3HCl,氢气遇氧气易爆炸,
故答案为:SiHCl3+3H2O═H2SiO3+H2↑+3HCl;高温下,H2遇O2发生爆炸;
(2)②SiHCl3和H2O剧烈反应生成H2SiO3、HCl和另一种物质,分析它们化合价的变化可知,![]() ,而Cl的化合价未发生变化,因此另一种元素即H元素的化合价必定降低,即另一种物质是H2,SiHCl3遇水剧烈反应生成H2SiO3、HCl和氢气:3SiHCl3+3H2O═H2SiO3+H2↑+3HCl,加热条件下,氢气遇氧气易爆炸,故答案为:3SiHCl3+3H2O═H2SiO3+H2↑+3HCl;爆炸;
,而Cl的化合价未发生变化,因此另一种元素即H元素的化合价必定降低,即另一种物质是H2,SiHCl3遇水剧烈反应生成H2SiO3、HCl和氢气:3SiHCl3+3H2O═H2SiO3+H2↑+3HCl,加热条件下,氢气遇氧气易爆炸,故答案为:3SiHCl3+3H2O═H2SiO3+H2↑+3HCl;爆炸;
(2)A.碳化硅属于原子晶体,化学性质稳定且熔点较高,但不可用于生产耐高温水泥,故错误;
B.氮化硅属于原子晶体,硬度大、熔点高,可用于制作高温陶瓷和轴承,故正确;
C.光导纤维的主要成分是二氧化硅,是利用光的全反射原理,故正确;
D.普玻璃是一种玻璃态物质,无固定的熔点,故错误;
E.盐酸不能与硅反应,而HCl在573K以上的温度下可与硅发生反应,故错误;
故选BC;
(3)硅酸的酸性小于硝酸,硅酸钠和硝酸反应生成难溶性的硅酸钠,所以看到有白色胶状物产生,反应方程式为,
故答案为:有白色胶状沉淀生成,反应原理为Na2SiO3+2HNO3=H2SiO3↓+2NaNO3。


科目:高中化学 来源: 题型:
【题目】X、Y、Z、Q、R五种元素的原子序数依次增大.其中:X的最外层电子排布为![]() ;Y是元素周期表中电负性最大的元素;Y、Z位于同一主族;Q基态原子核外的M能层中有两个未成对电子和三个空轨道;R位于第四周期ⅥB族。
;Y是元素周期表中电负性最大的元素;Y、Z位于同一主族;Q基态原子核外的M能层中有两个未成对电子和三个空轨道;R位于第四周期ⅥB族。
请回答下列问题:
![]() 元素基态原子的电子排布式为 ______ ,它的最高价氧化物的水化物的化学式为 ______ 。
元素基态原子的电子排布式为 ______ ,它的最高价氧化物的水化物的化学式为 ______ 。
![]() 分子的立体构型是 ______ ,中心原子的杂化方式是 ______ 。
分子的立体构型是 ______ ,中心原子的杂化方式是 ______ 。
![]() 与氮元素形成的一种化合物晶胞如图所示,该化合物的化学式为 ______。该晶体中与氮原子距离相等且最近的氮原子有 ______ 个。
与氮元素形成的一种化合物晶胞如图所示,该化合物的化学式为 ______。该晶体中与氮原子距离相等且最近的氮原子有 ______ 个。

![]() 化合物
化合物![]() 熔点为
熔点为![]() ,沸点为
,沸点为![]() ,熔融态不导电,可知
,熔融态不导电,可知![]() 的晶体类型是 ______
的晶体类型是 ______ ![]() 与热水反应的化学方程式为 ______ 。
与热水反应的化学方程式为 ______ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(Ⅰ)某化学反应A![]() B+C在三种不同条件下进行,B、C的起始浓度为0,反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表所示,表中温度为摄氏度(℃)。
B+C在三种不同条件下进行,B、C的起始浓度为0,反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表所示,表中温度为摄氏度(℃)。
实验 序号 | 0 | 10 | 20 | 30 | 40 | 50 | 60 | |
1 | 800 | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
2 | 800 | 1.0 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
3 | 820 | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
(1)该反应属于__________反应(填“可逆”或“不可逆”)。
(2)在实验1、2中,有一个实验使用了催化剂。请你利用表中数据判断实验___(填1或2)使用了催化剂,理由是_______________。
(3)该实验表明,影响化学反应速率的因素还有__________。
(II)下图是1molNO2和1molCO反应生成1molCO2和1molNO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:__________________。

该反应的活化能等于____________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在某体积固定的密闭容器中加入2 mol A和1 mol B,发生可逆反应![]() ,下列说法正确的是
,下列说法正确的是
A. 当容器内压强不变时说明反应已达到平衡
B. 当反应达到平衡时:c(A):c(B):c(C)=2:1:3
C. 当反应达到平衡时放出热量akJ
D. 其他条件不变,升高温度反应速率加快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修5:有机化学基础]端炔烃在催化剂存在下可发生偶联反应,称为Glaser反应。
2R—C≡C—H![]() R—C≡C—C≡C—R+H2
R—C≡C—C≡C—R+H2
该反应在研究新型发光材料、超分子化学等方面具有重要价值。下面是利用Glaser反应制备化合物E的一种合成路线:

回答下列问题:
(1)B的结构简式为______,D 的化学名称为______。
(2)①和③的反应类型分别为______、______。
(3)E的结构简式为______。用1 mol E合成1,4二苯基丁烷,理论上需要消耗氢气_______mol。
(4)化合物(![]() )也可发生Glaser偶联反应生成聚合物,该聚合反应的化学方程式为_____________________________________。
)也可发生Glaser偶联反应生成聚合物,该聚合反应的化学方程式为_____________________________________。
(5)芳香化合物F是C的同分异构体,其分子中只有两种不同化学环境的氢,数目比为3:1,写出其中3种的结构简式_______________________________。
(6)写出用2苯基乙醇为原料(其他无机试剂任选)制备化合物D的合成路线___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,可逆反应2NO2![]() 2NO+O2在体积固定的密闭容器中反应,达到平衡状态的标志是( )
2NO+O2在体积固定的密闭容器中反应,达到平衡状态的标志是( )
①单位时间内生成n mol O2,同时生成2n mol NO2
②单位时间内生成n mol O2,同时生成2n mol NO
③用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2:2:1
④混合气体的压强不再改变
⑤混合气体的颜色不再改变
⑥混合气体的平均相对分子质量不再改变
A.①④⑤⑥B.①②③⑤C.②③④⑥D.以上全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备苯甲醇和苯甲酸的化学原理是2C6H5CHO+NaOH![]() C6H5CH2OH+C6H5COONa,C6H5COONa+HCl→C6H5COOH+NaCl。已知苯甲醛易被空气氧化;苯甲醇的沸点为205.3 ℃,微溶于水,易溶于乙醚;苯甲酸的熔点为121.7 ℃,沸点为249 ℃,微溶于水,易溶于乙醚;乙醚的沸点为34.8 ℃,难溶于水。制备苯甲醇和苯甲酸的主要过程如图所示,根据以上信息判断,下列说法错误的是
C6H5CH2OH+C6H5COONa,C6H5COONa+HCl→C6H5COOH+NaCl。已知苯甲醛易被空气氧化;苯甲醇的沸点为205.3 ℃,微溶于水,易溶于乙醚;苯甲酸的熔点为121.7 ℃,沸点为249 ℃,微溶于水,易溶于乙醚;乙醚的沸点为34.8 ℃,难溶于水。制备苯甲醇和苯甲酸的主要过程如图所示,根据以上信息判断,下列说法错误的是
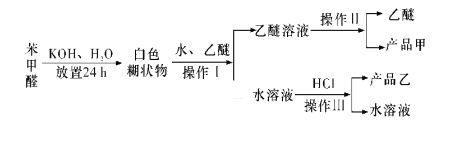
A.操作Ⅰ是萃取分液
B.操作Ⅱ蒸馏得到的产品甲是苯甲醇
C.操作Ⅲ过滤得到的产品乙是苯甲酸钠
D.乙醚溶液中所溶解的主要成分是苯甲醇
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z的原子序数依次增大。其中X与Y可形成一种淡黄色物质P,常温下将0.05 mol P溶于水,配成1 L溶液,其中![]() ;Z为金属元素,且Z可在W的一种氧化物中燃烧,生成一种白色的物质和一种黑色的物质。下列说法错误的是()
;Z为金属元素,且Z可在W的一种氧化物中燃烧,生成一种白色的物质和一种黑色的物质。下列说法错误的是()
A. 氢化物的沸点:W<X
B. 简单离子半径:X>Y>Z
C. 化合物P中既含有离子键又含有共价键
D. W、X、Y三种元素形成的物质的水溶液显碱性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年12月以来,我国武汉等地相继暴发了新冠肺炎,为此我国政府和相关部门采取了多项措施控制疫情。75%乙醇和84消毒液等均能有效灭活新冠病毒。84消毒液的主要成分是次氯酸钠。设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.74.5g次氯酸钠中含有的离子数目为2NA
B.1mol次氯酸钠与足量盐酸反应转移的电子数为2NA
C.46g75%乙醇中含有的氧原子数大于6NA
D.利用氯气和氢氧化钠溶液反应制取0.1mol次氯酸钠需要消耗2.24L氯气
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com