
【题目】(Ⅰ)某化学反应A![]() B+C在三种不同条件下进行,B、C的起始浓度为0,反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表所示,表中温度为摄氏度(℃)。
B+C在三种不同条件下进行,B、C的起始浓度为0,反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表所示,表中温度为摄氏度(℃)。
实验 序号 | 0 | 10 | 20 | 30 | 40 | 50 | 60 | |
1 | 800 | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
2 | 800 | 1.0 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
3 | 820 | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
(1)该反应属于__________反应(填“可逆”或“不可逆”)。
(2)在实验1、2中,有一个实验使用了催化剂。请你利用表中数据判断实验___(填1或2)使用了催化剂,理由是_______________。
(3)该实验表明,影响化学反应速率的因素还有__________。
(II)下图是1molNO2和1molCO反应生成1molCO2和1molNO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:__________________。

该反应的活化能等于____________________
【答案】可逆 2 反应速率较快(或反应达到平衡需要时间短) 温度 NO2(g) + CO(g) = CO2(g) + NO(g) △H=-234kJ/mol E1=134kJ/mol
【解析】
I.(1)由表格可知,随着反应时间的延长,A最终物质的量不变,且未消耗完,故该反应为可逆反应;
(2)由表格中数据对比可知,实验2达到平衡所需时间较实验1短很多,故实验2使用了催化剂;
故答案为:2;反应速率较快(或反应达到平衡需要时间短);
(3)实验3的反应温度升高了,相对于实验1速率加快了,故该实验表明,影响化学反应速率的因素还有温度;
II.由图可知,1molNO2和1molCO反应生成1molCO2和1molNO过程放出(368-134)kJ=234kJ能量,故该反应的热化学方程式为:NO2(g) + CO(g) = CO2(g) + NO(g) △H=-234kJ/mol;活化能是指分子从常态转变为容易发生化学反应的活跃状态所需要的能量,该反应的活化能为E1=134kJ/mol。


科目:高中化学 来源: 题型:
【题目】反应A+B→C △H <0,分两步进行 ① A+B→X △H>0 ② X→C △H<0 。下列示意图中,能正确表示总反应过程中能量变化的是
A.  B.
B. 
C.  D.
D. 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知三氯化铁的熔点为![]() ,沸点为
,沸点为![]() ,易溶于水并且有强烈的吸水性,能吸收空气里的水分而潮解。某学习小组的同学对氯气与铁的反应及产物做了如下探究实验:
,易溶于水并且有强烈的吸水性,能吸收空气里的水分而潮解。某学习小组的同学对氯气与铁的反应及产物做了如下探究实验:

(1)装碱石灰的仪器是_________(填仪器名称)。
(2)装置的连接顺序为____________。
(3)反应一段时间后熄灭酒精灯,冷却后将硬质玻璃管及收集器中的物质一并快速转移至锥形瓶中,加入过量的稀盐酸和少许植物油(反应过程中不振荡),充分反应后,进行如下实验:

①固体混合物的成分是____________。(填化学式)
②淡黄色溶液中加入试剂X生成淡红色溶液的离子反应方程式为________。
(4)已知红色褪去的同时有气体生成,经检验为![]() 。该小组内的同学们对红色褪去的原因提出了三种假设。
。该小组内的同学们对红色褪去的原因提出了三种假设。
假设Ⅰ:![]() 还原
还原![]() ,使其转变为
,使其转变为![]() ;
;
假设Ⅱ:![]() 分解生成
分解生成![]() ,
,![]() 氧化试剂X;
氧化试剂X;
假设Ⅲ:_______。(如果表达中遇到试剂X,请写出其化学式)。
并对假设进行了以下实验研究:
①取褪色后溶液三份,第一份滴加![]() 溶液无明显变化;第二份滴加试剂X,溶液出现红色;第三份滴加稀盐酸和
溶液无明显变化;第二份滴加试剂X,溶液出现红色;第三份滴加稀盐酸和![]() 溶液,产生白色沉淀。
溶液,产生白色沉淀。
②另取同浓度的 ![]() 溶液滴加2滴试剂X,溶液变红,再通入
溶液滴加2滴试剂X,溶液变红,再通入![]() ,无明显变化。实验①说明假设__________不正确;由实验①②得出假设________是正确的。
,无明显变化。实验①说明假设__________不正确;由实验①②得出假设________是正确的。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关催化剂的催化机理等问题可从“乙醇催化氧化实验”得到一些认识.下图是某化学兴趣小组设计的乙醇催化氧化的实验装置。(提示:通常用新制的Cu(OH)2悬浊液产生砖红色沉淀来检验物质中含有醛基)。
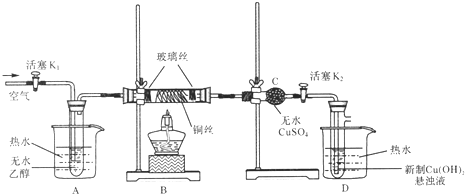
请据图回答以下问题:
(1)仪器连接安装完毕,进行实验前如何检验装置的气密性?答:_____________;
(2)对A中的乙醇采用水浴加热的目的是____________;
(3)实验时,点燃B处的酒精灯后,先____________,再集中火焰加热铜丝,随后向装置中不断地缓缓鼓入空气,此时B中观察到的现象是____________,发生的主要反应的化学方程式为____________,当反应进行一段时间后,移去酒精灯,继续不断缓缓地鼓入空气,B中仍重复如上现象,说明B处发生的反应是一个____________反应(填“吸热”或“放热”).
(4)装置C的作用是____________,能在此处观察到的现象是____________;
(5)装置D中的现象是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室在模拟工业制备和提纯硅时,利用氯气、石英砂和碳粉等原料按以下装置制备了SiCl4。已知SiCl4熔点-70°C,沸点57.6°C,遇水极易水解。

下列说法不正确的是( )
A.实验所用氯气等原料必须预先干燥处理
B.两通管中发生的化学反应为SiO2+C+2Cl2![]() SiCl4+CO2
SiCl4+CO2
C.液体X的作用是液化SiCl4气体,可以选择冰水等作冷却剂
D.若缺少固体Y的装置,实验时Z中可能会出现大量的白色烟雾
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2A(g)+B(g) ![]() 3C(g)+4D(g)反应中,表示该反应速率最快的是( )
3C(g)+4D(g)反应中,表示该反应速率最快的是( )
A. v(A)=0.5mol/L.s B. v(B)=0.3mol/L.s
C. v(c)=0.8mol/L.s D. v(D)=30mol/L.min
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室从含碘废液![]() 含有
含有![]() 、
、![]() 、
、![]() 、
、![]() 等
等![]() 中回收碘,操作过程如下:
中回收碘,操作过程如下:
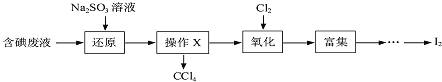
![]() 向废液中加入
向废液中加入![]() 溶液,发生“还原”反应的离子方程式为 ______。
溶液,发生“还原”反应的离子方程式为 ______。
![]() “氧化”操作在三颈烧瓶中进行,将溶液用盐酸调至pH约为2,缓慢通入
“氧化”操作在三颈烧瓶中进行,将溶液用盐酸调至pH约为2,缓慢通入![]() 。实验用水浴控制在
。实验用水浴控制在![]() 左右的较低温度下进行的原因是 ______。
左右的较低温度下进行的原因是 ______。
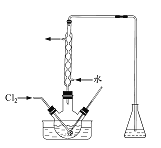
![]() 某研究小组用图装置对
某研究小组用图装置对![]() 与KI溶液的反应进行探究,发现通入
与KI溶液的反应进行探究,发现通入![]() 一段时间后,KI溶液变为黄色,继续通入
一段时间后,KI溶液变为黄色,继续通入![]() ,则溶液黄色变浅,最后变为无色.研究小组对所得无色溶液中碘元素的存在形态提出了以下假设:
,则溶液黄色变浅,最后变为无色.研究小组对所得无色溶液中碘元素的存在形态提出了以下假设:
假设一:没有![]() 形态;假设二:没有
形态;假设二:没有![]() 形态;假设三:有
形态;假设三:有![]() 形态。
形态。
![]() 请设计实验证明假设一成立
请设计实验证明假设一成立![]() 试剂自选
试剂自选![]() 。
。
实验操作 | 预期现象 | 结论 |
_______ | _______ | 假设一成立 |
![]() 若假设三成立,请写出生成
若假设三成立,请写出生成![]() 的离子方程式 ______。
的离子方程式 ______。
![]() 该研究小组还进行了对加碘盐中
该研究小组还进行了对加碘盐中![]() 含量测定的如下实验:
含量测定的如下实验:
![]() 准确称取加碘盐mg于烧杯中,加入适量蒸馏水和过量的KI,再滴入适量的稀硫酸,充分反应,将所得混合液配成
准确称取加碘盐mg于烧杯中,加入适量蒸馏水和过量的KI,再滴入适量的稀硫酸,充分反应,将所得混合液配成![]() 待测溶液.移取
待测溶液.移取![]() 待测溶液于锥形瓶中,加几滴淀粉试液,用c
待测溶液于锥形瓶中,加几滴淀粉试液,用c![]()
![]() 标准液滴定至终点,重复3次,测得平均值为VmL。
标准液滴定至终点,重复3次,测得平均值为VmL。
已知:![]() ,
,![]() 。测定时,判断达到滴定终点的现象为 ______ ,由测定数据可求得该样品中含
。测定时,判断达到滴定终点的现象为 ______ ,由测定数据可求得该样品中含![]() 的质量分数为 ______
的质量分数为 ______ ![]() 用含m、c、V的代数式表示,
用含m、c、V的代数式表示,![]()
![]() 。
。
![]() 在滴定操作正确无误的情况下,用此种测定方法测得的结果往往偏高,其原因是受空气的影响,请用离子方程式表示产生这一影响的原因 ______。
在滴定操作正确无误的情况下,用此种测定方法测得的结果往往偏高,其原因是受空气的影响,请用离子方程式表示产生这一影响的原因 ______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硅单质及其化合物应用范围很广。请回答下列问题:
(1)制备硅半导体材料必须先得到高纯硅。三氯甲硅烷(SiHCl3)还原法是当前
制备高纯硅的主要方法,生产过程示意图如下:
![]()
写出由纯SiHCl3制备高纯硅的化学反应方程式_______________________________。整个制备过程必须严格控制无水无氧。SiHCl3遇水剧烈反应生成H2SiO3、HCl和另一种物质,写出配平的化学反应方程式______________________________________________。H2还原SiHCl3过程中若混入O2,可能引起的后果是____________________________________________。
(2)下列有关硅材料的说法正确的是________(填字母)。
A.碳化硅化学性质稳定,可用于生产耐高温水泥
B.氮化硅硬度大、熔点高,可用于制作高温陶瓷和轴承
C.高纯度的二氧化硅可用于制造高性能通讯材料——光导纤维
D.普通玻璃是由纯碱、石灰石和石英砂制成的,其熔点很高
E.盐酸可以与硅反应,故采用盐酸为抛光液抛光单晶硅
(3)硅酸钠水溶液俗称水玻璃。取少量硅酸钠溶液于试管中,逐滴加入饱和氯化铵溶液,振荡。写出实验现象并给予解释。____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语的表达正确的是
A.Fe3+的最外层电子排布式:3s23p63d5
B.氯原子的结构示意图:
C.原子核内有10个中子的氧原子: ![]()
D.基态铜原子的价层电子排布图:![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com