
| A、Mg Al合金 |
| B、黄铜(Cu Zn合金) |
| C、Na K合金 |
| D、生铁(Fe C合金) |


科目:高中化学 来源: 题型:

| A、0~4分钟时,A的平均反应速率为0.01mol?L-1?min-1 |
| B、由T1向T2变化时,V正>V逆 |
| C、此反应的正反应为吸热反应 |
| D、其它条件不变,加压,达新平衡时,C的体积分数增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、金属的电化学腐蚀比化学腐蚀更普遍 |
| B、钢铁发生电化学腐蚀时,负极发生的反应是2H2O+O2+4e-═4OH- |
| C、钢铁在干燥空气中不易被腐蚀 |
| D、用牺牲锌块的方法来保护船身 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用量筒量取12.36ml盐酸 |
| B、用托盘天平称取2.7g食盐 |
| C、把浓硫酸沿杯壁注入水中并用玻璃棒搅拌,冷却至室温 |
| D、量筒没有零刻度线 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
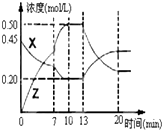 Ⅰ.在1L容器中通入CO2、H2各2mol,在一定条件下发生反应:CO2+H2?CO+H2O,
Ⅰ.在1L容器中通入CO2、H2各2mol,在一定条件下发生反应:CO2+H2?CO+H2O,查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com