
| A、电解饱和食盐水时,用铁作阳极,Cl-发生氧化反应 |
| B、电解法精炼铜时,纯铜作阴极,Cu2+发生还原反应 |
| C、电镀铜时,金属铜作阳极,电镀液可用硫酸铜溶液 |
| D、铜锌原电池中,锌作负极,电子从锌极流向铜极 |


 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案科目:高中化学 来源: 题型:
| A、检验溶液中SO42-的方法是:先加入BaCl2溶液,再加盐酸 |
| B、从溴水中提纯单质溴的方法是:先用CCl4萃取,分液后再蒸馏 |
| C、证明气体分子中含有“C=C”的方法是:将该气体通入KMnO4酸性溶液 |
| D、除去CO2中少量HCl的方法是:将混合气体通过盛有饱和NaHSO3溶液的洗气瓶 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1 mol甲烷中含有10NA个质子 |
| B、27g铝被完全氧化成氧化铝,失去2NA个电子 |
| C、标准状况下,22.4 L苯含有NA个C6H6分子 |
| D、常温常压下,28g乙烯含有2NA个碳碳双键 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、
| ||||
| B、同主族元素含氧酸的酸性随核电荷数的增加而减弱 | ||||
| C、同周期元素(除0族元素外)从左到右,原子半径逐渐减小 | ||||
| D、若M+和R2-的核外电子层结构相同,则原子序数R>M |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Mg(HCO3)2、NaCl |
| B、MgO、NaCl |
| C、MgCl2、Na2CO3 |
| D、MgCO3、NaCl |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在相同的条件下,2mol 氢气与 1 mol 氧气的总能量小于2mol 水蒸气的总能量 | ||
B、H2(g)+
| ||
| C、氢气燃烧是放热反应,所以氢气和氧气反应不需要其他外界条件即可发生 | ||
| D、任何条件下,2L水蒸气分解成2L氢气与1L氧气需吸收483.6kJ热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
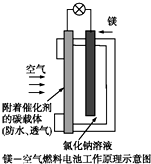 镁燃料电池作为一种高能化学电源,具有良好的应用前景.如图是镁-空气燃料电池工作原理示意图.下列有关该电池的说法正确的是( )
镁燃料电池作为一种高能化学电源,具有良好的应用前景.如图是镁-空气燃料电池工作原理示意图.下列有关该电池的说法正确的是( )| A、该电池Mg作负极,发生还原反应 |
| B、该电池的正极反应式为:O2+2H2O+4e-=4OH- |
| C、电池工作时,电子通过导线由碳电极流向Mg电极 |
| D、当电路中通过0.2 mol电子时,消耗的O2体积为1.12 L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、已知2H2(g)+O2(g)=2H2O(g)△H=-483.6kJ/mol,则氢气的燃烧热为241.8 kJ/mol |
| B、需要加热的化学反应,生成物的总能量一定高于反应物的总能量 |
| C、熵减的反应一定是非自发反应 |
| D、己知2C(s)+2O2(g)=2CO2(g)△H1,2C(s)+O2(g)=2CO(g)△H2,则△H1<△H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验编号 | 起始浓度(mol/L) | 反应后溶液的pH | |
| C(HA) | C(NaOH) | ||
| ① | 0.1 | 0.1 | 9 |
| ② | x | 0.2 | 7 |
| A、实验①反应后的溶液中C(Na+)>C(A-)>C(OH-)>C(H+) | ||
B、实验①反应后的溶液中C(OH-)=C(Na+)-C(A-)=
| ||
| C、实验②反应后的溶液中C(A-)+C(HA)=0.1 mol/L | ||
| D、实验②反应后的溶液中C(Na+)=C(A-)>C(OH-)=C(H+) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com