
【题目】下列有关工业生产的叙述正确的是( )
A.合成氨生产中将NH3液化分离,可提高N2、H2的转化率,增大了反应速率
B.硫酸工业中,在接触室安装热交换器是为了利用SO3转化为H2SO4时放出的热量
C.电解饱和食盐水制烧碱采用离子交换膜法,可防止阴极室产生的C12进入阳极室
D.侯氏制碱法是将氨气和二氧化碳先后通入饱和氯化钠溶液中,制得碳酸氢钠固体,再在高温下灼烧,转化为碳酸钠固体
科目:高中化学 来源: 题型:
【题目】下列叙述中正确的是
A. 稀醋酸与稀氢氧化钠溶液发生中和反应的热化学方程式为CH3COOH (aq) + NaOH (aq) = CH3COONa(aq) + H2O(l) ΔH=![]() 57.3kJ/mol
57.3kJ/mol
B. 在101kPa时1mol物质燃烧时的反应热叫做该物质的燃烧热
C. 未来氢气作为新能源的其中一个优点是充分燃烧的产物不污染环境
D. 升高温度或加入催化剂,可以改变化学反应的反应热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,二元酸H3PO3的pKa1、pKa2(pK=-lgK)依次为1.30、6.60,氨水的pKb为4.75。常温时,下列指定溶液中微粒物质的量浓度关系正确的是( )
A.0.1 mol·L-1NH4H2PO3溶液中:c(H3PO3)>c(NH3·H2O)>c(H+)>c(OH-)
B.0.1 mol·L-1H3PO3溶液用NaOH溶液滴定至pH=6.60:c(H2PO3-)=c(HPO32-)
C.0.1 mol·L-1H3PO3溶液用氨水滴定至pH=7.0:c(NH4+)=c(H2PO3- )+c(HPO32-)
D.0.4 mol·L-1氨水与0.2 mol·L-1NaH2PO3等体积混合(体积变化可忽略):c(NH3·H2O)<c(H2PO3-)+2c(H3PO3)+0.1 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式错误的是
A.用硅酸钠与盐酸反应制备硅胶:SiO32-+2H+=H2SiO3(胶体![]()
B.FeI2溶液中通入少量Cl2:2Fe2++Cl2=2Fe3++2Cl-
C.少量NaHSO4溶液与Ba(OH)2溶液反应:H++OH-+SO42-+Ba2+=H2O+BaSO4↓
D.FeCl3溶液中通入SO2,溶液黄色褪去:2Fe3++SO2+2H2O=2Fe2++SO42-+4H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨和硝酸都是重要的工业原料。
(1)标准状况下,将500L氨气溶于水形成1L氨水,则此氨水的物质的量浓度为____mol·L-1(保留三位有效数字)。工业上常用过量氨水吸收二氧化硫,该反应的化学方程式为____。
(2)氨氧化法是工业生产中合成硝酸的主要途径。合成的第一步是将氨和空气的混合气通过灼热的铂铑合金网,在合金网的催化下,氨被氧化成一氧化氮,该反应的化学方程式为____。
下列反应中的氨与氨氧化法中的氨作用相同的是____。
A.2Na+2NH3=2NaNH2+H2↑ B.2NH3+3CuO=3Cu+N2+3H2O
C.4NH3+6NO=5N2+6H2O D.HNO3+NH3=NH4NO3
工业中的尾气(假设只有NO和NO2)用烧碱进行吸收,反应的离子方程式为2NO2+2OH-=NO2-+NO3-+H2O和NO+NO2+2OH-=____+H2O(配平该方程式)。
(3)向27.2gCu和Cu2O的混合物中加入某浓度的稀HNO3500mL,反应过程中产生的气体只有NO。固体完全溶解后,在所得溶液(金属阳离子只有Cu2+)中加入1L1mol·L-1的NaOH溶液使金属离子恰好完全沉淀,此时溶液呈中性,所得沉淀质量为39.2g。
①Cu与稀HNO3反应的离子方程式为____。
②Cu与Cu2O的物质的量之比为____。
③HNO3的物质的量浓度为____mol·L-1。
(4)有H2SO4和HNO3的混合溶液20mL,加入0.25molL-1Ba(OH)2溶液时,生成沉淀的质量w(g)和Ba(OH)2溶液的体积V(mL)的关系如图所示(C点混合液呈中性)。则原混合液中H2SO4的物质的量浓度为____mol·L-1,HNO3的物质的量浓度为____mol·L-1。
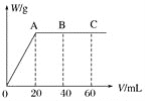
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汉黄芩素是传统中草药黄芩的有效成分之一,对肿瘤细胞的杀伤有独特作用。下列有关汉黄芩素的叙述正确的是( )
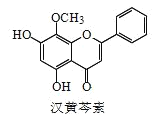
A.汉黄芩素的分子式为 C16H13O5
B.与足量 H2发生加成反应后,该分子中官能团的种类减少 1 种
C.1 mol 该物质与溴水反应,最多消耗 1mol Br2
D.该物质遇 FeCl3 溶液显色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组设计了一组实验来探究元素周期律。甲同学一次性完成N、C、Si的非金属性强弱的比较;乙同学完成了氧元素的非金属性比硫强的实验。
(1)从以下所给物质中选出甲同学设计的实验所用到物质:![]() 稀
稀![]() 溶液
溶液![]() 稀盐酸
稀盐酸![]() 碳酸钙
碳酸钙![]() 溶液
溶液![]()
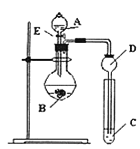
试剂A为______;试剂C为______![]() 填序号
填序号![]()
(2)乙同学设计的实验所用到试剂A为______;装置C中反应的化学方程式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物 G 是一种药物合成中间体,其合成如下:
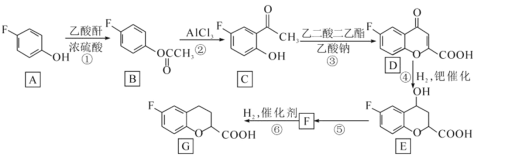
已知乙酸酐的结构简式为 CH3COOCOCH3。请回答下列问题:
(1)G 中含氧官能团的名称是_____。
(2)反应①的化学方程式为_____。
(3)写出反应⑤所需的试剂和条件是_____,该反应类型是_____。
(4)写出满足下列条件的 C 的同分异构体的结构简式_____、_____。
Ⅰ.苯环上只有两种取代基;
Ⅱ.核磁共振氢谱图中只有 4 组吸收峰;
Ⅲ.能与 NaHCO3 溶液反应生成二氧化碳。
(5)碳原子上连有 4 个不同的原子或基团时,该碳称为手性碳。则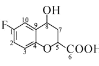 中的手性碳原子是_____(填碳原子的数字标号)。
中的手性碳原子是_____(填碳原子的数字标号)。
(6)设计以![]() (丙酸苯酚酯)为原料制备
(丙酸苯酚酯)为原料制备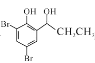 的合成路线(无机试剂任选)_____。
的合成路线(无机试剂任选)_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com