
【题目】下列离子方程式错误的是
A.用硅酸钠与盐酸反应制备硅胶:SiO32-+2H+=H2SiO3(胶体![]()
B.FeI2溶液中通入少量Cl2:2Fe2++Cl2=2Fe3++2Cl-
C.少量NaHSO4溶液与Ba(OH)2溶液反应:H++OH-+SO42-+Ba2+=H2O+BaSO4↓
D.FeCl3溶液中通入SO2,溶液黄色褪去:2Fe3++SO2+2H2O=2Fe2++SO42-+4H+
科目:高中化学 来源: 题型:
【题目】东晋《华阳国志南中志》卷四中已有关于白铜的记载,云南镍白铜(铜镍合金)文明中外,曾主要用于造币,亦可用于制作仿银饰品。回答下列问题:
(1)镍元素基态原子的价电子排布式为_________,3d能级上的未成对的电子数为______。
(2)硫酸镍溶于氨水形成[Ni(NH3)6]SO4蓝色溶液。
①[Ni(NH3)6]SO4中SO42-的立体构型是_____。
②在[Ni(NH3)6]2+中Ni2+与NH3之间形成的化学键称为______ ,提供空轨道的中心微粒是_____。
③氨的沸点_____(“高于”或“低于”)膦(PH3),原因是______;氨是_____分子(填“极性”或“非极性”),中心原子的轨道杂化类型为_______。
(3)单质铜及镍都是由______键形成的晶体:元素铜与镍的第二电离能分别为:ICu=1958kJ/mol,INi=1753kJ/mol,ICu>INi的原因是______。
(4)某镍白铜合金的立方晶胞结构如图所示。
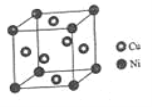
①晶胞中镍原子与铜原子的数量比为_____。
②若合金的密度为dg/cm3,晶胞参数a=________nm
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从海水中可以获得淡水、食盐,并可提取镁和溴等物质。
(1)海水淡化的方法有_______(填一种)。
(2)写出元素钠在元素周期表中的位置:_______。
(3)从海水中提取镁的流程如下图所示:
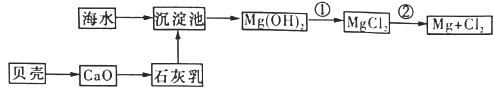
反应①的离子方程式为_______________。
反应②的化学方程式为_______________。
(4)从海水中提取溴的主要步骤是向浓缩的海水中通人氯气,将溴离子氧化,该反应的离子方程式为_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(化学---选修2:化学与技术)
南海某小岛上,可利用的淡水资源相当匮乏,解放军战士为了寻找合适的饮用水源,对岛上山泉水进行分析化验,结果显示山泉水属于硬水。
(1)硬水是指含有较多______________的水,硬水加热后产生沉淀的离子方程式为:________________________________(写出生成一种沉淀物的即可) 。
(2)硬度为1°的水是指每升水含10 mg CaO或与之相当的物质(如7.1 mg MgO),已知水的硬度在8°以下的称为软水,在8°以上的称为硬水。已知岛上山泉水中c( Ca2+)=1.2×10-3 mol/L,c(Mg2+) =6×l0-4mol/L,那么此水______(填“是”或“否”)属于硬水。
(3)离子交换法是软化水的常用方法。聚丙烯酸钠是一种离子交换树脂,写出聚丙烯酸钠单体的结构简式__________________。
(4)解放军战士通常向水中加入明矾净水,请用离子方程式解释其净水原理:______________。
(5)岛上还可以用海水淡化来获得淡水。下面是海水利用电渗析法获得淡水的原理图,已知海水中含Na+、Cl-、Ca2+、Mg2+、SO42-等离子,电极为惰性电极。请分析下列问题:
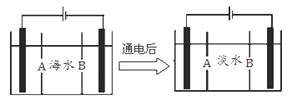
①阳离子交换膜是指___________(填A或B)。
②写出通电后阳极区的电极反应式____________,阴极区的现象是:_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙为两个容积均为1 L的恒容密闭容器,向甲中充入1 mol CH4和1 mol CO2,乙中充入1 mol CH4和m mol CO2,加入催化剂,只发生反应:CH4(g)+CO2(g)![]() 2CO(g)+2H2(g),测得CH4的平衡转化率随温度的变化如图所示。下列说法正确的是( )
2CO(g)+2H2(g),测得CH4的平衡转化率随温度的变化如图所示。下列说法正确的是( )
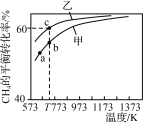
A.该反应的正反应是放热反应
B.a、b、c三点处,容器内气体总压强:p(a)<p(b)<p(c)
C.T K时,该反应的平衡常数小于12.96
D.恒温时向甲的平衡体系中再充入CO2、CH4各0.4 mol,CO、H2各1.2 mol,重新达平衡前,v(正)>v(逆)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关工业生产的叙述正确的是( )
A.合成氨生产中将NH3液化分离,可提高N2、H2的转化率,增大了反应速率
B.硫酸工业中,在接触室安装热交换器是为了利用SO3转化为H2SO4时放出的热量
C.电解饱和食盐水制烧碱采用离子交换膜法,可防止阴极室产生的C12进入阳极室
D.侯氏制碱法是将氨气和二氧化碳先后通入饱和氯化钠溶液中,制得碳酸氢钠固体,再在高温下灼烧,转化为碳酸钠固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】沼气的主要成分是CH4,还含有CO2、H2S等。Jo De Vrieze等设计了利用膜电解法脱除沼气中的CO2和H2S,并将阴极处理后气体制成高纯度生物甲烷,其流程如图所示。
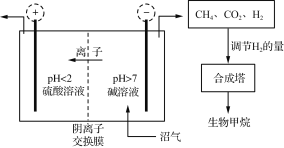
(1) 需控制电解槽中阴极室pH>7,其目的是________________。
(2) 阳极室逸出CO2和________(填化学式);H2S在阳极上转化为SO42-而除去,其电极反应式为___________________。
(3) 在合成塔中主要发生的反应为:
反应Ⅰ: CO2(g)+4H2(g)=CH4(g)+2H2O(g) ΔH1
反应Ⅱ: CO2(g)+H2(g)=CO(g)+H2O(g) ΔH2
调节![]() =4,充入合成塔,当气体总压强为0.1 MPa,平衡时各物质的物质的量分数如图1所示;不同压强时,CO2的平衡转化率如图2所示:
=4,充入合成塔,当气体总压强为0.1 MPa,平衡时各物质的物质的量分数如图1所示;不同压强时,CO2的平衡转化率如图2所示:
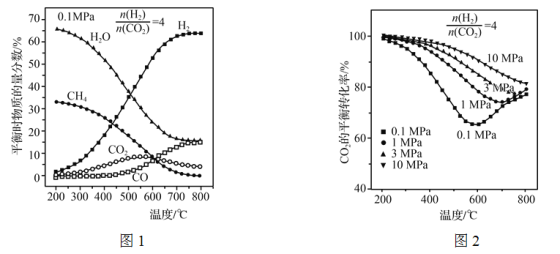
①反应CO2(g)+CH4(g)=2CO(g)+2H2(g)的△H=________(用ΔH1、ΔH2表示)。
②图1中,200~550 ℃时,CO2的物质的量分数随温度升高而增大的原因是__________。
③图2中,相同温度下,压强越大,CO2的平衡转化率越大,其原因是___________________;在压强为10 MPa时,当温度在200~800 ℃范围内,随温度升高,CO2的平衡转化率始终减小,其原因是________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】牛津大学与IBM苏黎世研究中心首次借助原子力显微镜(AFM)对分子甲及反应中间体乙、丙进行高分辨率的探测成像,并利用单原子操纵技术对其进行原子尺度的操作,通过针尖施加电压脉冲逐步切断![]() 基团,最终成功合成了2019年度明星分子丁。下列说法错误的是( )
基团,最终成功合成了2019年度明星分子丁。下列说法错误的是( )
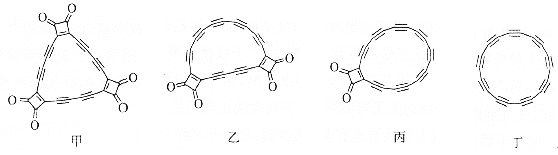
A.甲分子含有6个手性碳原子
B.反应中间体乙、丙都是碳的氧化物
C.丁和石墨互为同素异形体
D.甲生成丁的反应属于分解反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H7N9型禽流感是全球首次发现的新亚型流感病毒,达菲(Tamiflu)是治疗该病毒的最佳药物.以莽草酸为原料,经多步反应可制得达菲和对羟基苯甲酸.达菲、莽草酸、对羟基苯甲酸的结构简式如下:
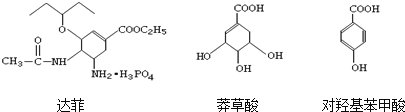
下列有关说法正确的是( )
A. 达菲、莽草酸、对羟基苯甲酸都属于芳香族化合物
B. 1mol莽草酸与NaOH溶液反应,最多消耗4mol NaOH
C. 对羟基苯甲酸较稳定,在空气中不易被氧化
D. 利用FeCl3溶液可区别莽草酸和对羟基苯甲酸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com