
����Ŀ��������������־����־�����������й��ڰ�ͭ�ļ��أ���������ͭ(ͭ���Ͻ�)�������⣬����Ҫ������ң������������������Ʒ���ش��������⣺
(1)��Ԫ�ػ�̬ԭ�ӵļ۵����Ų�ʽΪ_________��3d�ܼ��ϵ�δ�ɶԵĵ�����Ϊ______��
(2)���������ڰ�ˮ�γ�[Ni(NH3)6]SO4��ɫ��Һ��
��[Ni(NH3)6]SO4��SO42-�����幹����_____��
����[Ni(NH3)6]2+��Ni2+��NH3֮���γɵĻ�ѧ����Ϊ______ ���ṩ�չ������������_____��
�۰��ķе�_____(������������������)�(PH3)��ԭ����______������_____����(���������������Ǽ�����)������ԭ�ӵĹ���ӻ�����Ϊ_______��
(3)����ͭ����������______���γɵľ��壺Ԫ��ͭ�����ĵڶ������ֱܷ�Ϊ��ICu=1958kJ/mol��INi=1753kJ/mol��ICu��INi��ԭ����______��
(4)ij����ͭ�Ͻ�����������ṹ��ͼ��ʾ��
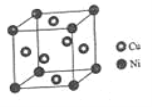
�پ�������ԭ����ͭԭ�ӵ�������Ϊ_____��
�����Ͻ���ܶ�Ϊdg/cm3����������a=________nm
���𰸡�3d84s2 2 �������� ��λ�� Ni2+ ���� NH3���Ӽ���γ���� ���� sp3 ���� ͭʧȥ����ȫ������3d10���ӣ���ʧȥ����4s1���� 1:3 
��������
��1��NiԪ��ԭ�Ӻ��������Ϊ28������������ԭ����д��������Ų�ʽ���ݴ��ж���Ԫ�ػ�̬ԭ��3d�ܼ��ϵ�δ�ɶԵĵ�������
��2���ٸ��ݼ۲���ӶԻ�������ȷ�����ӿռ乹�ͣ�
��һ���ṩ�µ��Ӷԣ�һ���ṩ�չ��������֮���γ���λ����
��PH3����֮��Ϊ���»�������������֮���γ���������������ʵķе㣬NH3Ϊ��λ���ӣ�Nԭ����1�Թ¶Ե��ӣ��γ�3��N-H�����ӻ������ĿΪ4����ԭ�Ӳ�ȡsp3�ӻ���
��3������ͭ���������ڽ������壻Cu+����Χ�����Ų�Ϊ3d10��Ni+����Χ�����Ų�Ϊ3d84s1��Cu+�ĺ�������Ų����ȶ���
��4���ٸ��ݾ�̯�����㾧����Ni��Cuԭ����Ŀ��
���������������ܶѻ�����Ͼ�����ԭ����Ŀ��ʾ�������������ٽ��m=��V���Լ��㾧���ⳤ��
��1��NiԪ��ԭ�Ӻ��������Ϊ28����������Ų�ʽΪ��1s22s22p63s23p63d84s2����۵���Ϊ3d84s2��3d�ܼ��ϵ�δ�ɶԵ�����Ϊ2���ʴ�Ϊ��3d84s2��2��
��2����SO42-��Sԭ�ӵŵ��Ӷ���=![]() =0���۲���Ӷ���=4+0=4�����ӿռ乹��Ϊ�������壬�ʴ�Ϊ���������壻
=0���۲���Ӷ���=4+0=4�����ӿռ乹��Ϊ�������壬�ʴ�Ϊ���������壻
��Ni2+�ṩ�չ����NH3��Nԭ�Ӻ��йµ��Ӷԣ�����֮���γ���λ�����ʴ�Ϊ����λ����Ni2+��
��PH3����֮��Ϊ���»�������������֮���γ���������Ӽ���������ǿ�����������ʵķе㣬�ʰ����ķе����PH3���ӵģ�NH3����ԭ��Nԭ�Ӽ۲���Ӷ�Ϊ3+1=4��VSEPRģ��Ϊ�����壬���ں���1�Թµ��Ӷԣ���Ϊ�����Σ�Ϊ���Է��ӣ�Nԭ�Ӳ���sp3�ӻ����ʴ�Ϊ�����ڣ�NH3���Ӽ���γ���������ԣ�sp3��
��3������ͭ���������ڽ������壬�����ɽ������γɵľ��壻Cu+����Χ�����Ų�Ϊ3d10��Ni+����Χ�����Ų�Ϊ3d84s1��Cu+�ĺ�������Ų����ȶ���ʧȥ�ڶ������Ӹ��ѣ�Ԫ��ͭ�ĵڶ������ܸ������ģ��ʴ�Ϊ��������ͭʧȥ����ȫ������3d10���ӣ���ʧȥ����4s1���ӣ�
��4���پ�����Ni���ڶ��㣬Cu�������ģ�����Niԭ����ĿΪ![]() =1��Cuԭ����ĿΪ
=1��Cuԭ����ĿΪ![]() ����������ԭ����ͭԭ�ӵ�������Ϊ1��3���ʴ�Ϊ��1��3��
����������ԭ����ͭԭ�ӵ�������Ϊ1��3���ʴ�Ϊ��1��3��
�ھ����������������ܶѻ���������������Ϊ![]() ������
������![]() ����
����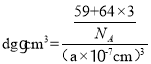 ���õ�a=
���õ�a=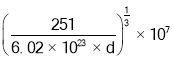 nm���ʴ�Ϊ��
nm���ʴ�Ϊ��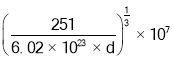 ��
��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�ռ���Ʒ�ֱ��ʺ�Na2CO3��ij��ѧ����С���ͬѧ�õζ����ⶨ���ռ���Ʒ��NaOH������������
�����ϣ����õ����ָʾ�������ɫ��Χ���£�
��̪��pH<8.2 ��ɫ 8.2<pH<10dz��ɫ pH>10 ��ɫ
���ȣ�pH<3.1��ɫ 3.1<pH<4.4��ɫ pH>4.4 ��ɫ
��ʵ�鲽�裩
I. Ѹ�ٵس�ȡ�ռ���Ʒ0.50g���ܽ�����Ƴ�100 mL��Һ�����á�
��.��0.1000mol/L HCl����Һװ����ʽ�ζ��ܣ����㣬��¼��ʼ����V0���ü�ʽ�ζ���ȡ20.00 mL��Ʒ��Һ����ƿ�У��μ�2�η�̪����HCl����Һ�ζ�����һ�յ㣨��ʱ����ΪNaCl��NaHCO3������¼��ʽ�ζ��ܵĶ���V1��Ȼ��������ƿ�ڵμ�2�μ��ȣ�������HCl����Һ�ζ����ڶ��յ㣬��¼��ʽ�ζ��ܵĶ���V2���ظ������������Σ���¼�������£�
ʵ����� | 1 | 2 | 3 |
V0/ mL | 0.00 | 0.00 | 0.00 |
V1/ mL | 21.72 | 21.68 | 21.70 |
V2/ mL | 23.72 | 23.68 | 23.70 |
��1������I������IJ����������ձ�������������ͷ�ιܺ�________��
��2�������йز���I����Ʒ��Һ��˵����ȷ����________������ĸ��ţ���
a. ��Ʒ��Һ��ˮ�ĵ���̶ȱ���ͬpH��NaOH��Һ�е�С
b. c(OH-)>c(CO32-)>c(HCO3-)
c. c(H+)+ c(Na+)=c(CO32-)+c(HCO3-)+ c(OH-)
d. �����Һ�еμ���������һ�յ�ʱ��n(Cl-)+n(CO32-)+n( HCO3-)+n(H2CO3)=n(Na+)
��3����ʽ�ζ���������ˮϴ����װ�����Һǰ��Ӧ���еIJ�����_______��
��4���ζ�����һ�յ�Ĺ����У�������Ӧ�����ӷ���ʽΪ_____��
��5���жϵζ����ڶ��յ����������Һ��___ɫ��Ϊ��ɫ��
��6����Ʒ��NaOH����������w(NaOH)= _____%��������������С�����1λ��
��7�����в����ᵼ�²�õ�NaOH��������ƫ�ߵ���____������ĸ��ţ���
a. �ﵽ��һ�յ�ǰ����ƿ�������ݲ���
b. ��¼��ʽ�ζ��ܶ���V1ʱ�����ӱ�ҺҺ��
c. ��һ�յ������ζ�ʱ����ƿ��������Һ�彦��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ��Ҫ���������ʵķ�����ᴿ�����У�ѡ��ǡ����ʵ�鷽������������ڿո�
A.��ȡ��Һ B.���� C.���ȷֽ� D.����
��1����ȥ![]() ������������
������������![]() ��_____________________��
��_____________________��
��2������ʳ��ˮ��ɳ�ӵĻ���___________________��
��3���ӵ�ˮ����ȡ�⣺________________________��
��4���������Ȼ�̼���е�![]() ���ͼױ����е�
���ͼױ����е�![]() ���Ļ���___________________��
���Ļ���___________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ж��ֻ��ϼۣ����γɶ��ֻ������ҵ���û���̿��ԭ������NO���йط�ӦΪ��C(s) + 2NO(g)![]() N2(g) + CO2(g)�����ܱյ�2L�����У�����NO�������Ļ���̿�����������·�Ӧ��
N2(g) + CO2(g)�����ܱյ�2L�����У�����NO�������Ļ���̿�����������·�Ӧ��
��1����2min�������ܶ�������1.2 g/L��������ƽ����Ӧ����Ϊ___________mol/(L�� min)��
��2���û�ѧƽ�ⳣ������ʽK =__________________����֪�����¶�ʱ��K����������ӦΪ______��������������������������Ӧ��
��3�����¶Ȳ���������£�Ҫ���NO��ƽ��ת���ʣ����Բ�ȡ�Ĵ�ʩ��____________��
��4�����и������жϸ÷�Ӧ�ﵽƽ�����____________________���������ĸ����
a��������ѹǿ���ֲ��䡡�� b��2v��(NO)��v��(N2)
c����������ƽ�������������� d�����������ܶȱ��ֲ���
��5����֪NaNO2��Һ�ʼ��ԣ���NaNO2��Һ������Ũ���ɴ�С��˳����_______________��
��6���ڴ��������£�NH3����������NO����Ⱦ���������ֶԻ����������ʡ�д����Ӧ�Ļ�ѧ����ʽ��____________�����б�������Ԫ��____ ���÷�Ӧ�����������뻹ԭ��������ʵ���֮����_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й��������˵������ȷ����(����)
A.Ũ������һ���ӷ���Һ������
B.Ũ�����ڿ����г��ڷ��ã�������ˮ������Ũ�ȼ�С
C.Ũ����ȶ����ֽ����ɶ���������������ˮ
D.�����£�Ũ���᳣��������ɫ�Լ�ƿ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25��ʱ��0.005molL��1Ba(
OH)
2��Һ��pHֵΪ��������
A.10B.11C.12D.13
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������Ҫ�Ļ���ԭ�ϡ�
(1)���鰱����������ˮ�ļ����ǣ��ռ�һ�Թܰ�����______________��
(2)������ʳ��ˮ������ͨ��������NH3��������CO2�����ɳ����Ļ�ѧʽΪ_________�����˺�ʹ��Һ�����������϶�NH4Cl����ķ����ǣ���ͨ��������NH3����ȴ������________����˵����������Ϊʲô���������϶�NH4Cl��ԭ��_________________��ijNaHCO3�����к���NaCl���ʣ�ijͬѧ�ڲⶨ����NaHCO3�ĺ���ʱ����ȡ5.000g���������ݳ�100mL��Һ���ñ�������Һ�ζ�(�ü�����ָʾ��)���ⶨ���ݼ�¼���£�
�ζ����� | ����Һ(mL) | 0.5000mol/L������Һ�����(mL) | |
������ | �ն��� | ||
��һ�� | 20.00 | 1.00 | 21.00 |
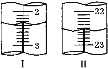
�ڶ��� | 20.00 | ��ͼ�� | ��ͼ�� |
(3)���ݹ�������Ҫ�õ����������ձ�����������___________��____________��
(4)���ζ���__________________________����Ϊ�ζ��յ㣻�ڶ��εζ�����ͼIͼII��ʾ���ĵ�������Һ���Ϊ_________mL��
(5)��ʵ��ⶨ��Ʒ��NaHCO3����������Ϊ__________(����2λС��)��
(6)����ͬѧ�ⶨ���ƫ����д��һ����ɸ�����ԭ��_____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ������ϡ������ͭ��Ӧ�Ʊ�NO���壬�������ͼ��װ��(��ƿ�ڼ���ϡ�����ͭƬ����Ҫʱ�ɼ���)��ʵ��Ч������ʮ�����룬��Ϊ�۲쵽������������֤����Ӧ������NO�����������ͼ��װ��(��Ƥ���¶�����ͭ˿Ȧ)����������ʵ����Դﵽ�����Ч����
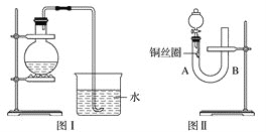
(1)��ͼ��װ����ʵ��ʱ������ˮ���ռ������������ɫΪ_____ɫ��ʵ�����������______�����۲쵽____________���ɣ��Ӷ���������֤����Ӧ������NO��
(2)��ͼ��װ����ʵ��ʱ�����йز���������ȫ��
�ٽ���Һ©���Ļ�������U�ιܵ�B��ܿ�ע��ϡ���ᣬһֱע��____________Ϊֹ��
�ڹرջ������þƾ�����U�ιܵ�A����ȣ���______ʱ��������ȥ�ƾ��ơ�
(3)����ͼ��װ�õ�ʵ������������⣺
�ٷ�Ӧ��ʲô����¿����Զ�ֹͣ��________________________��
���ںδ��۲쵽��ɫ��NO���壿____________________________________________��
���������Һ©���Ļ����������������۲쵽��Щ��������_________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ӷ���ʽ�������
A.�ù����������ᷴӦ�Ʊ��轺��SiO32-+2H+=H2SiO3(����![]()
B.FeI2��Һ��ͨ������Cl2��2Fe2++Cl2=2Fe3++2Cl-
C.����NaHSO4��Һ��Ba(OH)2��Һ��Ӧ��H++OH-+SO42-+Ba2+=H2O+BaSO4��
D.FeCl3��Һ��ͨ��SO2����Һ��ɫ��ȥ��2Fe3++SO2+2H2O=2Fe2++SO42-+4H+
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com