
【题目】(化学---选修2:化学与技术)
南海某小岛上,可利用的淡水资源相当匮乏,解放军战士为了寻找合适的饮用水源,对岛上山泉水进行分析化验,结果显示山泉水属于硬水。
(1)硬水是指含有较多______________的水,硬水加热后产生沉淀的离子方程式为:________________________________(写出生成一种沉淀物的即可) 。
(2)硬度为1°的水是指每升水含10 mg CaO或与之相当的物质(如7.1 mg MgO),已知水的硬度在8°以下的称为软水,在8°以上的称为硬水。已知岛上山泉水中c( Ca2+)=1.2×10-3 mol/L,c(Mg2+) =6×l0-4mol/L,那么此水______(填“是”或“否”)属于硬水。
(3)离子交换法是软化水的常用方法。聚丙烯酸钠是一种离子交换树脂,写出聚丙烯酸钠单体的结构简式__________________。
(4)解放军战士通常向水中加入明矾净水,请用离子方程式解释其净水原理:______________。
(5)岛上还可以用海水淡化来获得淡水。下面是海水利用电渗析法获得淡水的原理图,已知海水中含Na+、Cl-、Ca2+、Mg2+、SO42-等离子,电极为惰性电极。请分析下列问题:
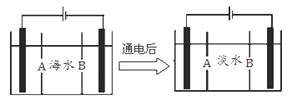
①阳离子交换膜是指___________(填A或B)。
②写出通电后阳极区的电极反应式____________,阴极区的现象是:_______________。
【答案】Ca2+或Mg2+ Ca2++ 2HCO3— ![]() CaCO 3↓+CO 2↑+H2O(或 Mg2++ 2HCO3
CaCO 3↓+CO 2↑+H2O(或 Mg2++ 2HCO3![]() MgCO3↓+CO2↑+H2O MgCO3+2H2O=Mg(OH)2+CO2↑+H2O ) 是 CH2=CHCOONa Al3++3H2O
MgCO3↓+CO2↑+H2O MgCO3+2H2O=Mg(OH)2+CO2↑+H2O ) 是 CH2=CHCOONa Al3++3H2O![]() Al(OH)3(胶体)+3H+ B 2Cl--2e-= Cl2↑ 电极上产生气泡,溶液中出现少量白色沉淀
Al(OH)3(胶体)+3H+ B 2Cl--2e-= Cl2↑ 电极上产生气泡,溶液中出现少量白色沉淀
【解析】
(1)硬水是含有较多可溶性钙盐、镁盐的水,硬水中的碳酸氢钙受热分解生成碳酸钙沉淀;
(2)依据硬度为1°的水是指每升水含10mgCaO或与之相当的物质(如7.1mgMgO),将水中的Ca2+、Mg2+质量折算成CaO的质量计算得到;
(3)聚丙烯酸钠的单体为丙烯酸钠;
(4)铝离子水解生成氢氧化铝和氢离子,氢氧化铝具有吸附性能够吸附杂质颗粒,可以用来净水;
(5)①阴离子交换膜只允许阴离子自由通过,阳离子交换膜只允许阳离子自由通过;
②根据阳极是氯离子放电,阴极区是氢离子得到电子生成氢气,氢氧根离子浓度增大。
(1)硬水是含有较多可溶性钙盐、镁盐的水,硬水中的碳酸氢钙受热分解生成碳酸钙沉淀,方程式为:Ca2++2HCO3-![]() CaCO3↓+CO2↑+H2O;
CaCO3↓+CO2↑+H2O;
(2)某天然水中c(Ca2+)=1.2×10-3mol?L-1,c(Mg2+)=6×10-4mol·L-1,硬度为1°的水是指每升水含10mgCaO或与之相当的物质(如7.1mgMgO);1L水中钙离子物质的量=1.2×10-3mol,相当于CaO质量=1.2×10-3mol×56g/mol=67.2mg,1L水中镁离子物质的量=6×10-4mol,相当于氧化镁质量6×10-4mol×40g/mol=24mg,水的硬度=![]()
![]()
=10°,属于硬水;
(3)聚丙烯酸钠的单体为丙烯钠,结构简式:CH2=CHCOONa;
(4)铝离子水解生成氢氧化铝和氢离子,离子方程式:Al3++3H2O![]() Al(OH)3(胶体)+3H+;
Al(OH)3(胶体)+3H+;
(5)①阴离子交换膜只允许阴离子自由通过,阳离子交换膜只允许阳离子自由通过,隔膜B和阴极相连,阴极是阳离子放电,所以隔膜B是阳离子交换膜;②根据阳极是氯离子放电:2Cl--2e-═Cl2↑,阴极区是氢离子得到电子生成氢气,氢氧根离子浓度增大,和钙离子,镁离子形成沉淀。


科目:高中化学 来源: 题型:
【题目】氮有多种化合价,能形成多种化合物。工业上用活性炭还原法处理NO,有关反应为:C(s) + 2NO(g)![]() N2(g) + CO2(g)。向密闭的2L容器中,加入NO和足量的活性炭,恒温条件下反应。
N2(g) + CO2(g)。向密闭的2L容器中,加入NO和足量的活性炭,恒温条件下反应。
(1)若2min内气体密度增大了1.2 g/L,则氮气的平均反应速率为___________mol/(L· min)。
(2)该化学平衡常数表达式K =__________________,已知升高温度时,K增大,则正反应为______(填“吸热”或“放热”)反应。
(3)在温度不变的情况下,要提高NO的平衡转化率,可以采取的措施是____________。
(4)下列各项能判断该反应达到平衡的是____________________(填序号字母)。
a.容器内压强保持不变 b.2v正(NO)=v逆(N2)
c.混合气体的平均分子质量不变 d.混合气体的密度保持不变
(5)已知NaNO2溶液呈碱性,则NaNO2溶液中离子浓度由大到小的顺序是_______________。
(6)在催化剂存在下,NH3可用来消除NO的污染,生成两种对环境无害的物质。写出反应的化学方程式:____________,其中被氧化的元素____ ,该反应中氧化产物与还原产物的物质的量之比是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用稀硝酸与铜反应制备NO气体,如果采用图Ⅰ装置(烧瓶内加入稀硝酸和铜片,必要时可加热),实验效果不是十分理想,因为观察到的现象不能有力证明反应产物是NO。有人设计了图Ⅱ装置(橡皮塞下端连有铜丝圈),用来做该实验可以达到满意的效果。
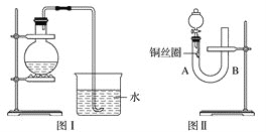
(1)用图Ⅰ装置做实验时,用排水法收集到的气体的颜色为_____色;实验过程中由于______,不易观察到____________生成,从而不能有力证明反应产物是NO。
(2)用图Ⅱ装置做实验时,将有关操作补充完全:
①将分液漏斗的活塞打开,从U形管的B侧管口注入稀硝酸,一直注到____________为止。
②关闭活塞,用酒精灯在U形管的A侧加热,当______时,立即撤去酒精灯。
(3)根据图Ⅱ装置的实验完成下列问题:
①反应在什么情况下可以自动停止?________________________。
可在何处观察到无色的NO气体?____________________________________________。
②如果将分液漏斗的活塞慢慢打开,可立即观察到哪些明显现象?_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中正确的是
A. 稀醋酸与稀氢氧化钠溶液发生中和反应的热化学方程式为CH3COOH (aq) + NaOH (aq) = CH3COONa(aq) + H2O(l) ΔH=![]() 57.3kJ/mol
57.3kJ/mol
B. 在101kPa时1mol物质燃烧时的反应热叫做该物质的燃烧热
C. 未来氢气作为新能源的其中一个优点是充分燃烧的产物不污染环境
D. 升高温度或加入催化剂,可以改变化学反应的反应热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学按照课本实验要求,用 50mL 0.50 mol·L-1 的盐酸与 50mL 0.50 mol·L-1 的NaOH溶液在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量计算反应热。下列 说法中,不正确的是( )
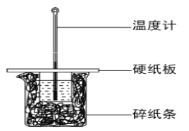
A.实验过程中有一定的热量损失
B.图中实验装置缺少环形玻璃搅拌棒
C.烧杯间填满碎纸条的主要作用是固定小烧杯
D.若将盐酸体积改为 60 mL,理论上所求反应热相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,二元酸H3PO3的pKa1、pKa2(pK=-lgK)依次为1.30、6.60,氨水的pKb为4.75。常温时,下列指定溶液中微粒物质的量浓度关系正确的是( )
A.0.1 mol·L-1NH4H2PO3溶液中:c(H3PO3)>c(NH3·H2O)>c(H+)>c(OH-)
B.0.1 mol·L-1H3PO3溶液用NaOH溶液滴定至pH=6.60:c(H2PO3-)=c(HPO32-)
C.0.1 mol·L-1H3PO3溶液用氨水滴定至pH=7.0:c(NH4+)=c(H2PO3- )+c(HPO32-)
D.0.4 mol·L-1氨水与0.2 mol·L-1NaH2PO3等体积混合(体积变化可忽略):c(NH3·H2O)<c(H2PO3-)+2c(H3PO3)+0.1 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式错误的是
A.用硅酸钠与盐酸反应制备硅胶:SiO32-+2H+=H2SiO3(胶体![]()
B.FeI2溶液中通入少量Cl2:2Fe2++Cl2=2Fe3++2Cl-
C.少量NaHSO4溶液与Ba(OH)2溶液反应:H++OH-+SO42-+Ba2+=H2O+BaSO4↓
D.FeCl3溶液中通入SO2,溶液黄色褪去:2Fe3++SO2+2H2O=2Fe2++SO42-+4H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汉黄芩素是传统中草药黄芩的有效成分之一,对肿瘤细胞的杀伤有独特作用。下列有关汉黄芩素的叙述正确的是( )
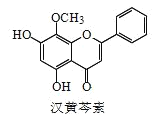
A.汉黄芩素的分子式为 C16H13O5
B.与足量 H2发生加成反应后,该分子中官能团的种类减少 1 种
C.1 mol 该物质与溴水反应,最多消耗 1mol Br2
D.该物质遇 FeCl3 溶液显色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组学生利用装置用![]() 盐酸滴定未知浓度的NaOH溶液,并用酚酞作为指示剂
盐酸滴定未知浓度的NaOH溶液,并用酚酞作为指示剂
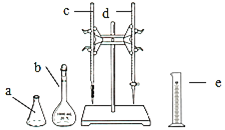
(1)量取![]() 待测NaOH溶液时,用到的测量仪器是 ______
待测NaOH溶液时,用到的测量仪器是 ______ ![]() 填仪器标号
填仪器标号![]() .
.
(2)仪器![]() 中,需要用待装液润洗的有 ______
中,需要用待装液润洗的有 ______ ![]() 填字母
填字母![]()
(3)该滴定实验过程中,判定滴定终点的依据是 ______
(4)该实验小组重复三次的实验数据如下表所示,计算NaOH溶液的浓度为 ______
实验序号 | 盐酸体积 | NaOH溶液体积 |
1 |
|
|
2 |
|
|
3 |
|
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com