
| A、①③④ | B、②③④ |
| C、①②③④⑤ | D、①②③④⑤⑥ |


科目:高中化学 来源: 题型:
A、
| ||
B、
| ||
C、
| ||
D、
|
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、1 L该硫酸中氢原子的物质的量为36.8 mol |
| B、该硫酸与等体积的水混合所得溶液的质量分数小于49% |
| C、配制250.0 mL 4.6 mol/L的稀硫酸需取该硫酸62.5 mL |
| D、稀释该硫酸的方法是将水倒入盛该酸的量筒中 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、25℃时,pH=13的1.0L Ba(OH)2溶液中含有的OH-数目为0.2NA |
| B、1 mol Cl2与足量Fe反应,转移的电子数为3NA |
| C、标准状况下,以任意比混合的氢气和一氧化碳气体共8.96 L,在足量氧气中充分燃烧时消耗氧气的分子数为0.2NA |
| D、7.1 g Cl2与足量的NaOH溶液反应转移的电子数约为0.2 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CCl4曾用作灭火剂,但因与水在高温下反应会产生有毒物质,现已被禁用 |
| B、蔗糖、油脂及它们的水解产物均为非电解质 |
| C、棉花、羊毛、腈纶和涤纶都属于合成纤维 |
| D、将纳米材料分散到液体分散剂中,该分散系可发生丁达尔现象,可推测纳米材料的直径为1~100nm之间 |
查看答案和解析>>
科目:高中化学 来源: 题型:
89 39 |
| A、属于金属元素 | ||||
| B、质子数与中子数之差为50 | ||||
| C、原子的核外电子数是39 | ||||
D、
|
查看答案和解析>>
科目:高中化学 来源: 题型:
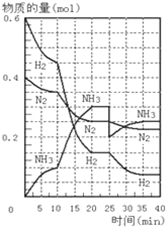 500℃、20MPa时,将H2和N2置于一容积为2L的密闭容器中发生反应:3H2+N2?2NH3△H<0.反应过程中H2、N2和NH3物质的量变化如图所示,据图判断下列叙述不正确的是( )
500℃、20MPa时,将H2和N2置于一容积为2L的密闭容器中发生反应:3H2+N2?2NH3△H<0.反应过程中H2、N2和NH3物质的量变化如图所示,据图判断下列叙述不正确的是( )| A、反应开始到第一次平衡时,N2的平均反应速率为0.0625mol?(L?min)-1,H2的转化率为75% |
| B、反应达到第一次平衡时,反应的平衡常数表达式可写作:K=c2(NH3)/[c3(H2)?c(N2)]=(0.15 mol?L-1)2/[(0.075 mol?L-1)3?(0.125 mol?L-1)] |
| C、从曲线变化可以看出,反应进行到10min至20min时可能采取的措施是使用了催化剂 |
| D、从曲线变化可以看出,反应进行至25min时,采取的措施是分离出0.1mol的氨气,平衡正向移动 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com