
【题目】NA表示阿伏加德罗常数的值,下列叙述不正确的是( )
A.60gSiO2晶体含4NA个σ键
B.78gNa2O2晶体中含有离子个数为4NA
C.在12g石墨中含CC共价键数目为1.5NA
D.CO和N2是等电子体,标况下22.4L的CO气体与1molN2所含的电子数相等
 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案科目:高中化学 来源: 题型:
【题目】铁是重要的工业元素。
(1)铁元素位于周期表中的___________区,Fe的外围电子排布的轨道表示式为_____,Fe的7个能级中能量最高的是__________________。
(2)(NH4)2Fe(SO4)2·6H2O俗称摩尔盐,其中H2O的VSEPR模型名称为______________。写出一种与SO42-互为等电子体的分子的化学式__________________。
(3)金属Fe具有导电性,温度越高其导电性越____________,其原因是__________________。
(4)ZnCl2浓溶液常用于除去Fe表面的氧化物,反应可得[Zn(OH)2Cl2]2-溶液。[Zn(OH)2Cl2]2-中肯定不存在的微粒间作用力有_________________(填选项字母);
A.离子键 B.共价键 C.金属键 D.配位键 E.范德华力
画出溶液中[Zn(OH)2Cl2]2-的结构式,并表示出配位键____________________。
(5)某种磁性氮化铁的结构如图所示 ,Fe为____________堆积,N随机排列在Fe构成的正四面体空隙中,空隙的占有率为
,Fe为____________堆积,N随机排列在Fe构成的正四面体空隙中,空隙的占有率为![]() ,则该化合物的化学式为_____________。 其中铁原子最近的铁原子的个数为_________________;氮化铁晶胞底边长为a nm,高为c nm,则这种磁性氮化铁的晶体密度为__________g·cm-3(用含a、c和NA的计算式表示)。
,则该化合物的化学式为_____________。 其中铁原子最近的铁原子的个数为_________________;氮化铁晶胞底边长为a nm,高为c nm,则这种磁性氮化铁的晶体密度为__________g·cm-3(用含a、c和NA的计算式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将9.0 g铜和铁的混合物投入100 mL稀硝酸中并加热,充分反应后得到标准状况下1.12 L NO,剩余4.8 g金属;继续加入100 mL等浓度的稀硝酸,金属完全溶解,又得到标准状况下1.12 L NO。若向反应后的溶液中加入KSCN溶液,溶液不变红,则下列说法正确的是 ( )
A.原混合物中铜和铁的物质的量均为0.075 mol
B.反应前稀硝酸的物质的量浓度无法计算
C.若向上述最后所得溶液中再加入足量稀硝酸,还可得到标准状况下1.12 L NO
D.第一次与100 mL稀硝酸反应后剩余的4.8 g金属为铜和铁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图装置(夹持、加热装置已略)进行实验,有②中现象,不能证实①中反应发生的是( )
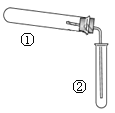
①中实验 | ②中现象 | |
Ⅰ | 铁粉与水蒸气加热 | 肥皂水冒泡 |
Ⅱ | 加热NH4Cl和Ca(OH)2混合物 | 酚酞溶液变红 |
Ⅲ | NaHCO3 | 澄清石灰水变浑浊 |
A.只有ⅠB.只有Ⅱ
C.只有ⅢD.Ⅰ、Ⅱ、Ⅲ均能证实①中反应发生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,针对表中的①~⑨种元素,填写下列空白:
主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | Ⅵ | VⅡA | 0 |
2 | ① | ② | ③ | |||||
3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
4 | ⑨ |
(1)在这些元素中,化学性质最不活泼的是___(填元素符号)。
(2)②③⑦三种元素的原子半径从大到小的顺序为___(填元素符号)。
(3)在最高价氧化物的水化物中,酸性最强的化合物的化学式___,碱性最强的化合物的名称___。
(4)元素⑤的氧化物与元素④的最高价氧化物对应水化物反应的化学方程式为:___。
(5)元素⑥和⑦形成的气态氢化物较稳定是___(填化学式),用方程式来说明元素⑦的非金属性比⑥的非金属强的事实___(一个或两个方程式均可)。
(6)表示①与③形成的化合物的电子式___,写出它的一种用途___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了强化安全管理,某油库引进一台测空气中汽油含量的测量仪,其工作原理如图所示(用强酸性溶液作电解质溶液)。下列说法不正确的是
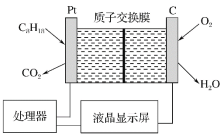
A.石墨电极作正极,发生还原反应
B.铂电极的电极反应式:C8H18+16H2O-50e-===8CO2↑+50H+
C.H+由质子交换膜左侧向右侧迁移
D.每消耗 5.6 L O2,电路中通过 1 mol 电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量的CO2与足量的碳在体积可变的恒压密闭容器中反应:C(s)+CO2(g)![]() 2CO(g),平衡时,体系中气体体积分数与温度的关系如图所示:
2CO(g),平衡时,体系中气体体积分数与温度的关系如图所示:
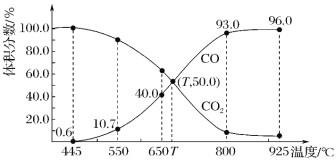
已知:气体分压(p分)=气体总压(p总)×体积分数。下列说法正确的是
A.650 ℃时,反应达平衡后 CO2 的转化率为 25.0%
B.550 ℃时,若充入惰性气体,v(正)、v(逆)均减小,平衡不移动
C.T ℃时,若充入等体积的 CO2 和 CO,平衡向正反应方向移动
D.925 ℃时,用平衡分压代替平衡浓度表示的化学平衡常数 Kp=24.0p总
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出下列有机物的类别及所含官能团的名称。
(1)CH3CH=CH2____、_________;
(2)HC≡C—CH2CH3__________、__________;
(3)![]() _________、___________;
_________、___________;
(4)![]() _________、_________;
_________、_________;
(5)![]() _________、___________;
_________、___________;
(6)CH3CH2—O—CH3__________、__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醋酸溶液中存在电离平衡:CH3COOH![]() H++CH3COO,下列叙述不正确的是
H++CH3COO,下列叙述不正确的是
A.升高温度,平衡正向移动,醋酸的电离常数Ka增大
B.0.10 mol/L的CH3COOH溶液加水稀释,溶液中c(OH-)增大。
C.CH3COOH溶液中加少量的CH3COONa固体,平衡逆向移动
D.25℃时,欲使醋酸溶液的pH、电离常数Ka和电离程度都减小,可加入少量冰醋酸。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com