
【题目】用如图装置(夹持、加热装置已略)进行实验,有②中现象,不能证实①中反应发生的是( )
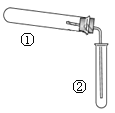
①中实验 | ②中现象 | |
Ⅰ | 铁粉与水蒸气加热 | 肥皂水冒泡 |
Ⅱ | 加热NH4Cl和Ca(OH)2混合物 | 酚酞溶液变红 |
Ⅲ | NaHCO3 | 澄清石灰水变浑浊 |
A.只有ⅠB.只有Ⅱ
C.只有ⅢD.Ⅰ、Ⅱ、Ⅲ均能证实①中反应发生
 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:
【题目】2019年诺贝尔化学奖授予了在锂离子电池发展中做出突出贡献的三位科学家。一种应用于公共交通的高能LiFePO4电池的结构如图所示,电池中间是聚合物的隔膜,工作时只允许Li+通过。该电池工作原理:(1-x)LiFePO4+xFePO4+LixCn![]() LiFePO4+nC。
LiFePO4+nC。

下列说法不正确的是( )
A.放电时,右侧的电极为负极
B.充电时,Li+向左移动
C.充电时,每转移1mol电子,石墨电极增重7g
D.放电时,正极反应式:xFePO4+xLi++xe-=xLiFePO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关中和热概念、中和热测定实验(如图)的说法正确的是
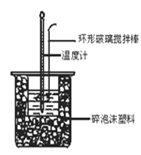
A.已知在稀溶液中:H+(aq)+OH-(aq) =H2O(l);ΔH=-57.3kJ·mol-1,则有![]() H2SO4(aq)+
H2SO4(aq)+![]() Ba(OH)2(aq)=
Ba(OH)2(aq)= ![]() BaSO4(s)+H2O(l) △H=-57.3kJ·mol-1
BaSO4(s)+H2O(l) △H=-57.3kJ·mol-1
B.已知2NaOH(aq)+H2SO4(aq)=Na2SO4(aq)+2H2O(l) △H=-114.6kJ·mol-1,则该反应的中和热为114.6 kJ·mol-1。
C.中和热测定实验过程中,环形玻璃搅拌棒材料若用铜代替,则测量出的中和热数值偏小
D.酸碱混合时,量筒中的NaOH溶液应分多次倒入已装有盐酸的小烧杯中,并不断用环形玻璃搅拌棒搅拌。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校学生化学实验小组,为验证非金属元素氯的氧化性强于硫和氮,设计了一套实验装置:(部分夹持装置已略去)
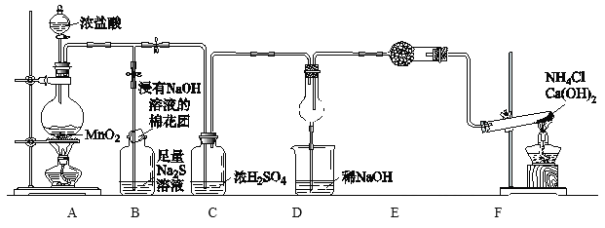
(1)写出A中反应的离子方程式___________________________。
(2)写出F中反应的化学方程式_________________________。
(3)B中浸有NaOH溶液的棉花作用___________________,B中溶液出现现象_______________,写出B中发生的离子反应_________________。
(4)E中干燥管装的干燥剂是________,检验F中气体的方法______________。
(5)D中干燥管中出现的现象______________,D中干燥管中化学方程式_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.已知2A2(g)+B2(g)![]() 2C(g) ΔH=-a kJ/mol(a>0),在一个有催化剂的固定容积的容器中加入2 mol A2和1 mol B2,在500 ℃时充分反应达到平衡后C的浓度为w mol/L,放出热量b kJ。
2C(g) ΔH=-a kJ/mol(a>0),在一个有催化剂的固定容积的容器中加入2 mol A2和1 mol B2,在500 ℃时充分反应达到平衡后C的浓度为w mol/L,放出热量b kJ。
(1)a________b(填“>”“=”或“<”)。
(2)若将反应温度升高到700 ℃,该反应的平衡常数将________(填“增大”“减小”或“不变”)。
(3)若在原来的容器中,只加入2 mol C,500 ℃时充分反应达到平衡后, C的浓度________w mol/L(填“>”“=”或“<”)
(4)使该反应的反应速率增大,且平衡向正反应方向移动的操作是________。
a.及时分离出C气体 b.适当升高温度
c.增大B2的浓度 d.选择高效的催化剂
II.氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:3SiO2(s)+6C(s)+ 2N2(g)![]() Si3N4(s)+ 6CO(g) △H>0 。
Si3N4(s)+ 6CO(g) △H>0 。
(1)该反应的平衡常数表达式为__________。
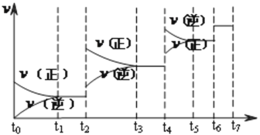
(2)达到平衡后,改变某一外界条件(不改变N2、CO的量),反应速率![]() 与时间t的关系如下图。图中t3时引起平衡移动的条件可以是____________________;t4时引起平衡移动的条件可以是____________________;图中表示平衡混合物中CO的含量最高的一段时间是_________。
与时间t的关系如下图。图中t3时引起平衡移动的条件可以是____________________;t4时引起平衡移动的条件可以是____________________;图中表示平衡混合物中CO的含量最高的一段时间是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过以下反应可获得新型能源二甲醚(![]() )。下列说法不正确的是
)。下列说法不正确的是
①![]()
![]()
②![]()
![]()
③![]()
![]()
④![]()
![]()
A. 反应①、②为反应③提供原料气
B. 反应③也是![]() 资源化利用的方法之一
资源化利用的方法之一
C. 反应![]() 的
的![]()
D. 反应![]() 的
的![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数的值,下列叙述不正确的是( )
A.60gSiO2晶体含4NA个σ键
B.78gNa2O2晶体中含有离子个数为4NA
C.在12g石墨中含CC共价键数目为1.5NA
D.CO和N2是等电子体,标况下22.4L的CO气体与1molN2所含的电子数相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,其中所列数字分别代表某一元素。

请你根据表中所给元素,回答下列问题:
(1)表中属于d区的元素是_________(填编号)。
(2)⑤⑥⑦三种元素中电负性最大的是_____(填写元素符号),在第二周期中第一电离能介于②和③之间的元素有_______种;
(3)元素⑨在周期表中的位置_______________。
(4)元素⑧和⑦能形成一种常见的干燥剂,它的电子式为_____________。
(5)写出下列有关反应的离子方程式:⑩的单质与元素③的最高价氧化物,对应的水化物的稀溶液反应:___________________________。
(6)⑥和⑦相比较,非金属性较弱的是______(填元素符号),可以验证你的结论的是下列中的_____(填编号)。
a.气态氢化物的稳定性; b.两元素的电负性;c.含氧酸的酸性; d. 最高化合价
(7)①与③的元素形成的10电子中性分子X的空间构型为_____,它极易溶于水中,请简要说明该物质易溶于水的原因_______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(14分)工业上常用苏打烧结法提取自然界中的稀散元素硒(Se),我国科研人员自主设计的利用粗铜电解精炼所产生含硒化亚铜(Cu2Se)和碲化亚铜(Cu2Te)的阳极泥为原料,提取硒的某种工艺流程如图所示。

回答下列问题:
(1)电解精炼铜时,电源的正极连接_______(填“粗铜”或“精铜”),阳极溶解铜的质量__________(填“>”“=”或“<”)阴极析出铜的质量。
(2)“烧结”时苏打和硒化亚铜主要生成了Na2SeO3、Cu2O和CO2气体,该反应的化学方程式为________________________________。“烧结”时生成了少部分Na2SeO4,写出“还原”时反应的离子方程式____________。
(3)含硒烧结物浸取时,最佳加热方式为________________,除去的物质为___________(填化学式)。
(4)本工艺副产物TeO2用于制造红外器件、声光器件材料,可溶于强酸和强碱,并形成复盐,则TeO2属于______氧化物(填“酸性”“碱性”或“两性”)。
(5)把硫酸工业第一步的产物SO2通入Na2SeO3溶液制备硒单质,写出该反应的离子方程式_____________。若得到50 kg硒单质,至少需要___________kg质量分数为90%的FeS2矿石。(结果保留一位小数)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com