
【题目】某校学生化学实验小组,为验证非金属元素氯的氧化性强于硫和氮,设计了一套实验装置:(部分夹持装置已略去)
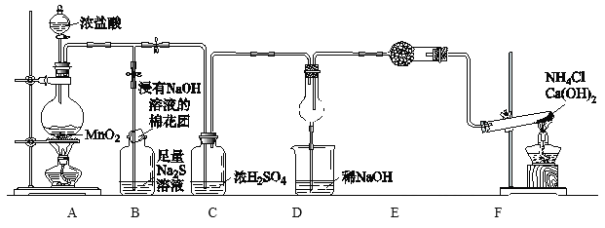
(1)写出A中反应的离子方程式___________________________。
(2)写出F中反应的化学方程式_________________________。
(3)B中浸有NaOH溶液的棉花作用___________________,B中溶液出现现象_______________,写出B中发生的离子反应_________________。
(4)E中干燥管装的干燥剂是________,检验F中气体的方法______________。
(5)D中干燥管中出现的现象______________,D中干燥管中化学方程式_________________。
【答案】MnO2 +4H++2Cl-![]() Mn2++Cl2↑+2H2O Ca(OH)2+2NH4Cl
Mn2++Cl2↑+2H2O Ca(OH)2+2NH4Cl![]() CaCl2+2NH3↑+2H2O 吸收过量的氯气,防止污染环境 有淡黄色沉淀生成 S2- +Cl2 =S +2Cl- 碱石灰 湿润的红色石蕊试纸变蓝 有白烟生成 8NH3+3Cl2=N2+6NH4Cl
CaCl2+2NH3↑+2H2O 吸收过量的氯气,防止污染环境 有淡黄色沉淀生成 S2- +Cl2 =S +2Cl- 碱石灰 湿润的红色石蕊试纸变蓝 有白烟生成 8NH3+3Cl2=N2+6NH4Cl
【解析】
(1)反应装置A为浓盐酸和二氧化锰共热制备氯气,其离子方程式为:MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O;
Mn2++Cl2↑+2H2O;
(2)装置F中氯化铵和氢氧化钙加热制取氨气,反应的化学方程式是Ca(OH)2+2NH4Cl![]() CaCl2+2NH3↑+2H2O;
CaCl2+2NH3↑+2H2O;
(3)氢氧化钠溶液能与氯气反应生成氯化钠、次氯酸钠,B中浸有NaOH溶液的棉花作用是吸收过量的氯气,防止污染环境;B中Na2S和氯气反应生成氯化钠和硫单质,B中的现象是有淡黄色沉淀生成,反应的离子方程式是S2- +Cl2 =S +2Cl-;
(4)氨气是碱性气体,一般用碱石灰干燥氨气,E中干燥管装的干燥剂是碱石灰;氨气的水溶液呈碱性,氨气能使湿润的红色石蕊试纸变蓝,用湿润的红色石蕊试纸检验氨气;
(5)氨气、氯气反应生成氯化铵和氮气,D中干燥管中出现的现象是有白烟生成,反应方程式是8NH3+3Cl2=N2+6NH4Cl。


科目:高中化学 来源: 题型:
【题目】A、B、C、D四种芳香族化合物都是某些植物挥发油中的主要成分,有的是药物,有的是香料。它们的结构简式如下所示:
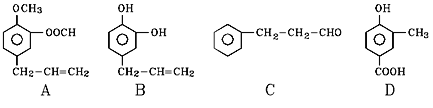
请回答下列问题:
(1)写出B中官能团的名称___________________;1mol B能与含____molBr2的溴水反应。
(2)既能使FeCl3溶液显紫色又能和NaHCO3溶液反应放出气体的是_________(用A、B、C、D填空)。
(3)按下图C经一步反应可生成E,E是B的同分异构体,则反应①属于______反应(填反应类型名称);酯F分子中共有11个碳原子,写出反应②的化学方程式____________________________。
![]()
(4)同时符合下列两项要求的D的同分异构体有4种:
①都是苯的1,2—二取代物;
②两个取代基分别为-OH和含有-COO-结构的基团
其中两种(G和H)结构简式如图所示,请补充另外两种。
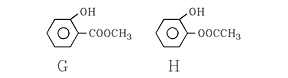
_______________________、_______________________________。
(5)写出H与足量NaOH溶液共热反应的化学方程式____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制取硝基苯的方法如图所示:
(1)写出该反应的反应方程式:______,
(2)该反应中,长导管的作用是______,实验中采用如图所示的加热方式是为了____
(3)实验完成后,将试管内的物质倒入水中______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭容器中加入A、B、C三种气体,保持一定温度,在t1~t4时刻测得各物质的浓度如下表。据此判断下列结论正确的是( )
测定时刻/s | t1 | t2 | t3 | t4 |
c(A)/(mol/L) | 6 | 3 | 2 | 2 |
c(B)/(mol/L) | 5 | 3.5 | 3 | 3 |
c(C)/(mol/L) | 1 | 2.5 | 3 | 3 |
A.在t3时刻反应已经停止
B.A的转化率比B的转化率低
C.在容器中发生的反应为:2A+B![]() 2C
2C
D.在t2~t3内A的平均反应速率为:[1/(t3-t2)]mol/(L·s)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将9.0 g铜和铁的混合物投入100 mL稀硝酸中并加热,充分反应后得到标准状况下1.12 L NO,剩余4.8 g金属;继续加入100 mL等浓度的稀硝酸,金属完全溶解,又得到标准状况下1.12 L NO。若向反应后的溶液中加入KSCN溶液,溶液不变红,则下列说法正确的是 ( )
A.原混合物中铜和铁的物质的量均为0.075 mol
B.反应前稀硝酸的物质的量浓度无法计算
C.若向上述最后所得溶液中再加入足量稀硝酸,还可得到标准状况下1.12 L NO
D.第一次与100 mL稀硝酸反应后剩余的4.8 g金属为铜和铁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在300mL的密闭容器中,放入镍粉并充入一定量的CO气体,一定条件下发生反应:Ni(s) + 4CO(g) ![]() Ni(CO)4(g),已知该反应平衡常数与温度的关系如表:
Ni(CO)4(g),已知该反应平衡常数与温度的关系如表:
温度/℃ | 25 | 80 | 230 |
平衡常数 | 5×104 | 2 | 1.9×10-5 |
下列说法不正确的是
A.上述生成Ni(CO)4(g)的反应为放热反应
B.25℃时反应Ni(CO)4(g) ![]() Ni(s)+4CO(g)的平衡常数为2×10-5
Ni(s)+4CO(g)的平衡常数为2×10-5
C.80℃达到平衡时,测得![]() ,则Ni(CO)4的平衡浓度为2mol/L
,则Ni(CO)4的平衡浓度为2mol/L
D.在80℃时,测得某时刻,Ni(CO)4、CO浓度均为0.5mol/L,则此时反应向正向进行。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图装置(夹持、加热装置已略)进行实验,有②中现象,不能证实①中反应发生的是( )
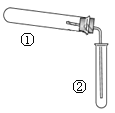
①中实验 | ②中现象 | |
Ⅰ | 铁粉与水蒸气加热 | 肥皂水冒泡 |
Ⅱ | 加热NH4Cl和Ca(OH)2混合物 | 酚酞溶液变红 |
Ⅲ | NaHCO3 | 澄清石灰水变浑浊 |
A.只有ⅠB.只有Ⅱ
C.只有ⅢD.Ⅰ、Ⅱ、Ⅲ均能证实①中反应发生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了强化安全管理,某油库引进一台测空气中汽油含量的测量仪,其工作原理如图所示(用强酸性溶液作电解质溶液)。下列说法不正确的是
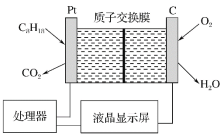
A.石墨电极作正极,发生还原反应
B.铂电极的电极反应式:C8H18+16H2O-50e-===8CO2↑+50H+
C.H+由质子交换膜左侧向右侧迁移
D.每消耗 5.6 L O2,电路中通过 1 mol 电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是
A. 0.1mol/L的Na2CO3溶液加适量水稀释后,溶液中![]() 变大
变大
B. 若使Na2S溶液中![]() 接近于2︰1,可加入适量的KOH固体
接近于2︰1,可加入适量的KOH固体
C. 25℃时,浓度均为0. 1mol/L NaOH和NH3·H2O混合溶液中c(OH- )>c(Na+ )=c(NH3·H2O)
D. 0.2 mol/L CH3COOH溶液与0. 1mol/L NaOH溶液等体积混合:2c(H+)-2c(OH -)=c(CH3COO-)-c(CH3COOH)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com