
【题目】下列说法错误的是
A. 0.1mol/L的Na2CO3溶液加适量水稀释后,溶液中![]() 变大
变大
B. 若使Na2S溶液中![]() 接近于2︰1,可加入适量的KOH固体
接近于2︰1,可加入适量的KOH固体
C. 25℃时,浓度均为0. 1mol/L NaOH和NH3·H2O混合溶液中c(OH- )>c(Na+ )=c(NH3·H2O)
D. 0.2 mol/L CH3COOH溶液与0. 1mol/L NaOH溶液等体积混合:2c(H+)-2c(OH -)=c(CH3COO-)-c(CH3COOH)
【答案】C
【解析】
A. Na2CO3溶液加适量水稀释后,促进水解,所以氢氧根离子浓度变大,碳酸根离子浓度减小,所以溶液中![]() 变大,则
变大,则![]() 变大,所以A选项是正确的;
变大,所以A选项是正确的;
B、适量KOH固体,水解平衡向着逆向移动,使得S2-的物质的量增大,而钠离子的物质的量不变,从而可使Na2S溶液中![]() 接近于2:1,所以B选项是正确的;
接近于2:1,所以B选项是正确的;
C、混合溶液中,氢氧化钠和一水合氨的混合比例未知,故无法判断c(Na+)= c(NH3·H2O),故C错误;
D、0.2 mol/L CH3COOH溶液与0. 1mol/L NaOH溶液等体积混合后,得到等物质的量浓度的醋酸和醋酸钠的混合溶液,根据物料守恒:2c(Na+)=c(CH3COO-)+c(CH3COOH),根据电荷守恒:c(Na+)+c(H+)=c(CH3COO-)+c(OH-),因此可得:2c(H+)-2c(OH -)=c(CH3COO-)-c(CH3COOH),所以D选项是正确的。
故选C。


科目:高中化学 来源: 题型:
【题目】某校学生化学实验小组,为验证非金属元素氯的氧化性强于硫和氮,设计了一套实验装置:(部分夹持装置已略去)
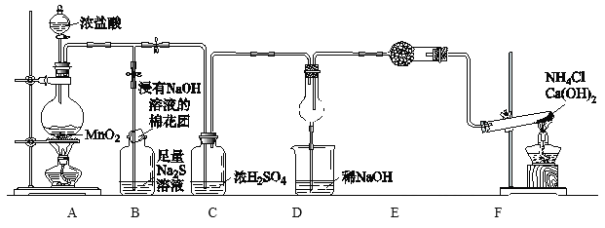
(1)写出A中反应的离子方程式___________________________。
(2)写出F中反应的化学方程式_________________________。
(3)B中浸有NaOH溶液的棉花作用___________________,B中溶液出现现象_______________,写出B中发生的离子反应_________________。
(4)E中干燥管装的干燥剂是________,检验F中气体的方法______________。
(5)D中干燥管中出现的现象______________,D中干燥管中化学方程式_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,其中所列数字分别代表某一元素。

请你根据表中所给元素,回答下列问题:
(1)表中属于d区的元素是_________(填编号)。
(2)⑤⑥⑦三种元素中电负性最大的是_____(填写元素符号),在第二周期中第一电离能介于②和③之间的元素有_______种;
(3)元素⑨在周期表中的位置_______________。
(4)元素⑧和⑦能形成一种常见的干燥剂,它的电子式为_____________。
(5)写出下列有关反应的离子方程式:⑩的单质与元素③的最高价氧化物,对应的水化物的稀溶液反应:___________________________。
(6)⑥和⑦相比较,非金属性较弱的是______(填元素符号),可以验证你的结论的是下列中的_____(填编号)。
a.气态氢化物的稳定性; b.两元素的电负性;c.含氧酸的酸性; d. 最高化合价
(7)①与③的元素形成的10电子中性分子X的空间构型为_____,它极易溶于水中,请简要说明该物质易溶于水的原因_______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)X射线衍射测定等发现,I3AsF6中存在I3+离子。I3+离子的几何构型为_____,中心原子的杂化类型为_____。
(2)CS2分子中,C原子的杂化轨道类型是_____。
(3)F2通入稀NaOH溶液中可生成OF2,OF2分子构型为_____,其中氧原子的杂化方式为_____。
(4)CH3COOH中C原子轨道杂化类型为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属钼在工业和国防建设中有重要的作用。钼(Mo)的常见化合价为+6、+5、+4。由钼精矿(主要成分是MoS2)可制备单质钼和钼酸钠晶体(Na2MoO4·2H2O),部分流程如图1所示:
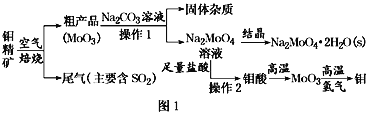
已知:钼酸微溶于水,可溶于液碱和氨水。
回答下列问题:
(1)焙烧钼精矿时发生的化学方程式为_____________________________。
(2)钼精矿焙烧时排放的尾气对环境的主要危害是___________________,请提出一种实验室除去该尾气的方法____________________________________。
(3)操作2的名称为________。由钼酸得到MoO3所用到的硅酸盐材料仪器的名称是________。
(4)焙烧钼精矿所用的装置是多层焙烧炉,图2为各炉层固体物料的物质的量的百分数(φ)。
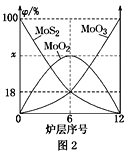
①x=________。
②焙烧炉中也会发生MoS2与MoO3反应生成MoO2和SO2的反应,若该反应转移6mol电子,则消耗的氧化剂的化学式及物质的量分别为________、________。
(5)操作1中,加入碳酸钠溶液充分反应后,碱浸液中c(MoO42-)=0.80mol·L1,c(SO42-)=0.04 mol·L1,在结晶前需加入Ba(OH)2固体以除去溶液中的SO42-。当BaMoO4开始沉淀时,SO42-的去除率是________。[Ksp(BaSO4)=1.1×1010、Ksp(BaMoO4)=4.0×108,溶液体积变化可忽略不计]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铅蓄电池的充放电反应为Pb(s)+PbO2(s)+2H2SO4(aq)![]() 2PbSO4(s)+2H2O(1)。某铅蓄电池的正、负极标记被磨损,试用如困装置设计实验,识别出此铅蓄电池的正、负极。
2PbSO4(s)+2H2O(1)。某铅蓄电池的正、负极标记被磨损,试用如困装置设计实验,识别出此铅蓄电池的正、负极。
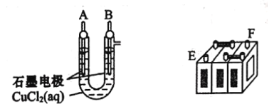
(1)将A接E、B接F,B电极出现_____________现象,电极反应式为_____________,说明F为正极。
(2)铅蓄电池工作时(放电),E电极的反应式为_____________,充电时该极与外接电源的_____________极相连。
(3)若有0.2mol电子发生转移,则正极消耗PbO2的物质的量是______mol。
(4)如图是在金属锌板上贴上一张用某溶液浸湿的滤纸。
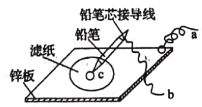
①若用硫酸钠和酚酞的混合溶液浸湿滤纸,用导线将a、b直接相连,则滤纸出现____色,铅笔芯c点处的电极反应式为________________。
②若用KI-淀粉溶液浸湿滤纸,用导线将a、b与铅蓄电池的E、F电极相连,铅笔芯c点处出现蓝色,则b接的是_______(填“E”或“F”)电极。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(14分)工业上常用苏打烧结法提取自然界中的稀散元素硒(Se),我国科研人员自主设计的利用粗铜电解精炼所产生含硒化亚铜(Cu2Se)和碲化亚铜(Cu2Te)的阳极泥为原料,提取硒的某种工艺流程如图所示。

回答下列问题:
(1)电解精炼铜时,电源的正极连接_______(填“粗铜”或“精铜”),阳极溶解铜的质量__________(填“>”“=”或“<”)阴极析出铜的质量。
(2)“烧结”时苏打和硒化亚铜主要生成了Na2SeO3、Cu2O和CO2气体,该反应的化学方程式为________________________________。“烧结”时生成了少部分Na2SeO4,写出“还原”时反应的离子方程式____________。
(3)含硒烧结物浸取时,最佳加热方式为________________,除去的物质为___________(填化学式)。
(4)本工艺副产物TeO2用于制造红外器件、声光器件材料,可溶于强酸和强碱,并形成复盐,则TeO2属于______氧化物(填“酸性”“碱性”或“两性”)。
(5)把硫酸工业第一步的产物SO2通入Na2SeO3溶液制备硒单质,写出该反应的离子方程式_____________。若得到50 kg硒单质,至少需要___________kg质量分数为90%的FeS2矿石。(结果保留一位小数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,现有浓度均为0.10mol/L的三种溶液:①NaCl溶液、②CH3COONa溶液、③CH3COOH溶液。请回答:
(1)三种溶液中,pH>7的是__________(填序号),其原因是________________________________________(用离子方程式表示)。pH<7的是__________(填序号),其原因是________________________________________(用化学用语表示)。
(2)下列说法正确的是__________(填序号)。
a.CH3COONa是弱电解质
b.CH3COONa和CH3COOH都能促进水的电离
c.①②两种溶液等体积混合后,溶液中c(Na+)+c(H+)=c(Cl-)+c(CH3COO-)+c(OH-)
(3)②③两种溶液等体积混合后,溶液pH<7,该混合溶液中离子浓度大小关系是_____________________
(4) 25℃时,电解1.00L饱和NaCl溶液一段时间后,收集到1.12LH2(标准状况)。该反应的离子方程式是____________,此时溶液的pH是____________(不考虑溶液体积的变化)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甘氨酸亚铁![]() 是一种补铁强化剂。实验室利用
是一种补铁强化剂。实验室利用![]() 与甘氨酸
与甘氨酸![]() 制备甘氨酸亚铁,实验装置如下图所示(夹持和加热仪器已省略)。
制备甘氨酸亚铁,实验装置如下图所示(夹持和加热仪器已省略)。

查阅资料:
①甘氨酸易溶于水,微溶于乙醇;甘氨酸亚铁易溶于水,难溶于乙醇。
②柠檬酸易溶于水和乙醇,具有较强的还原性和酸性。
实验过程:
I.装置C中盛有17.4g![]() 和200mL1.0mol·L-1甘氨酸溶液。实验时,先打开仪器a的活塞,待装置c中空气排净后,加热并不断搅拌;然后向三颈瓶中滴加柠檬酸溶液。
和200mL1.0mol·L-1甘氨酸溶液。实验时,先打开仪器a的活塞,待装置c中空气排净后,加热并不断搅拌;然后向三颈瓶中滴加柠檬酸溶液。
Ⅱ.反应结束后过滤,将滤液进行蒸发浓缩;加入无水乙醇,过滤、洗涤并干燥。
(1)仪器a的名称是________;与a相比,仪器b的优点是________。
(2)装置B中盛有的试剂是:_______;装置D的作用是________。
(3)向![]() 溶液中加入
溶液中加入![]() 溶液可制得
溶液可制得![]() ,该反应的离子方程式为________。
,该反应的离子方程式为________。
(4)过程I加入柠檬酸促进![]() 溶解并调节溶液pH,溶液pH与甘氨酸亚铁产率的关系如图所示。
溶解并调节溶液pH,溶液pH与甘氨酸亚铁产率的关系如图所示。
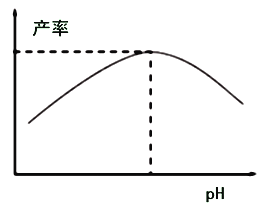
①pH过低或过高均导致产率下降,pH过高导致产率下降其原因是________;
②柠檬酸的作用还有________。
(5)过程II中加入无水乙醇的目的是________。
(6)本实验制得15.3g甘氨酸亚铁,则其产率是_______%。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com