
【题目】25℃时,现有浓度均为0.10mol/L的三种溶液:①NaCl溶液、②CH3COONa溶液、③CH3COOH溶液。请回答:
(1)三种溶液中,pH>7的是__________(填序号),其原因是________________________________________(用离子方程式表示)。pH<7的是__________(填序号),其原因是________________________________________(用化学用语表示)。
(2)下列说法正确的是__________(填序号)。
a.CH3COONa是弱电解质
b.CH3COONa和CH3COOH都能促进水的电离
c.①②两种溶液等体积混合后,溶液中c(Na+)+c(H+)=c(Cl-)+c(CH3COO-)+c(OH-)
(3)②③两种溶液等体积混合后,溶液pH<7,该混合溶液中离子浓度大小关系是_____________________
(4) 25℃时,电解1.00L饱和NaCl溶液一段时间后,收集到1.12LH2(标准状况)。该反应的离子方程式是____________,此时溶液的pH是____________(不考虑溶液体积的变化)。
【答案】② CH3COO-+H2OCH3COOH+OH- ③ CH3COOHCH3COO-+H+ c c (CH3COO-)> c(Na+)> c (H+)> c(OH-) 2Cl+2H2O 2OH+H2↑+Cl2↑ 13
2OH+H2↑+Cl2↑ 13
【解析】
(1) 强碱强酸盐溶液不水解显中性,强碱弱酸盐水解显碱性;醋酸电离显酸性;
(2)能够水解的盐促进水电离,溶液中存在电荷守恒;
(3)二者混合后,溶质为等物质的量CH3COONa和CH3COOH,溶液中存在平衡CH3COO+H2OCH3COOH+OH-、CH3COOHCH3COO+H+,由于溶液pH<7说明电离程度大于水解程度,据此分析各离子浓度大小关系;
(4)电解饱和食盐水,阴极生成氢气,阳极生成氯气,根据反应关系计算产生的n(OH),进而计算出c(OH)。
(1)氯化钠溶液为强碱强酸盐溶液呈中性,25℃时pH=7;CH3COONa溶液为强碱弱酸盐,醋酸根水解CH3COO-+H2OCH3COOH+OH-,溶液显碱性,25℃时pH>7;CH3COOH溶液为弱酸溶液,存在醋酸的电离CH3COOHCH3COO-+H+,溶液显酸性,25℃时pH<7;
(2)a.CH3COONa在水溶液中完全电离成醋酸根和钠离子,是强电解质,故a错误;
b. 醋酸钠中醋酸根水解促进水的电离,醋酸溶液中醋酸的电离抑制水的电离,故b错误;
c. ①②两种溶液等体积混合后溶液中存在电荷守恒c(Na+)+c (H+)=c (Cl-)+c (CH3COO-)+c (OH-),故c正确,所以选c;
(3)二者混合后,溶质为等物质的量CH3COONa和CH3COOH,溶液中存在平衡CH3COO+H2OCH3COOH+OH-、CH3COOHCH3COO+H+,由于溶液pH<7说明电离程度大于水解程度,所以溶液中的c (CH3COO-)> c (CH3COOH),溶液中存在物料守恒2c(Na+)= c (CH3COO-)+c (CH3COOH),所以c (CH3COO-)> c(Na+),所以溶液中离子浓度大小关系为c (CH3COO-)> c(Na+)> c (H+)> c(OH-);
(4)电解饱和食盐水,阴极生成氢气,阳极生成氯气,离子方程式为:2Cl+2H2O 2OH+H2↑+Cl2↑;生成的氢气的物质的量为
2OH+H2↑+Cl2↑;生成的氢气的物质的量为![]() =0.05mol,根据方程式可知生成的n(OH)=0.1mol,则c(OH)=
=0.05mol,根据方程式可知生成的n(OH)=0.1mol,则c(OH)=![]() =0.1mol/L,溶液pH=13。
=0.1mol/L,溶液pH=13。


科目:高中化学 来源: 题型:
【题目】为了强化安全管理,某油库引进一台测空气中汽油含量的测量仪,其工作原理如图所示(用强酸性溶液作电解质溶液)。下列说法不正确的是
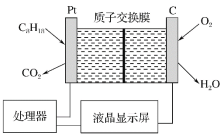
A.石墨电极作正极,发生还原反应
B.铂电极的电极反应式:C8H18+16H2O-50e-===8CO2↑+50H+
C.H+由质子交换膜左侧向右侧迁移
D.每消耗 5.6 L O2,电路中通过 1 mol 电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是
A. 0.1mol/L的Na2CO3溶液加适量水稀释后,溶液中![]() 变大
变大
B. 若使Na2S溶液中![]() 接近于2︰1,可加入适量的KOH固体
接近于2︰1,可加入适量的KOH固体
C. 25℃时,浓度均为0. 1mol/L NaOH和NH3·H2O混合溶液中c(OH- )>c(Na+ )=c(NH3·H2O)
D. 0.2 mol/L CH3COOH溶液与0. 1mol/L NaOH溶液等体积混合:2c(H+)-2c(OH -)=c(CH3COO-)-c(CH3COOH)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】除了酸以外,某些盐也能溶解沉淀。利用如表三种试剂进行实验,相关分析不正确的是
编号 | ① | ② | ③ |
分散质 | Mg(OH)2 | HCl | NH4Cl |
备注 | 悬浊液 | 1mol/L | 1mol/L |
A.向①中加入②,c(OH-)减小,Mg(OH)2溶解平衡正向移动
B.向①中加入酚酞显红色说明物质的“不溶性”是相对的
C.向①中加入③沉淀溶解,说明Mg(OH)2比NH3·H2O更难电离
D.①、③混合后发生反应:Mg(OH)2(s)+2NH4+![]() Mg2++2NH3·H2O
Mg2++2NH3·H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醋酸溶液中存在电离平衡:CH3COOH![]() H++CH3COO,下列叙述不正确的是
H++CH3COO,下列叙述不正确的是
A.升高温度,平衡正向移动,醋酸的电离常数Ka增大
B.0.10 mol/L的CH3COOH溶液加水稀释,溶液中c(OH-)增大。
C.CH3COOH溶液中加少量的CH3COONa固体,平衡逆向移动
D.25℃时,欲使醋酸溶液的pH、电离常数Ka和电离程度都减小,可加入少量冰醋酸。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)二氧化硫一空气质子交换膜燃料电池可以利用大气所含SO2快速启动,其装置示意图如图:

①质子的流动方向为________________(“从A到B”或“从B到A”)。
②负极的电极反应式为________________。
(2)工业上吸收和转化SO2的电解装置示意图如下(A.B均为惰性电极):
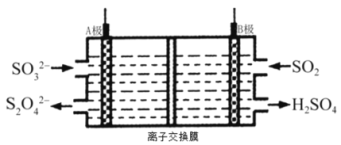
①B极接电源的________________极(“负”或“正”)。
②A极的电极反应式是_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空:
(1)有机物命名:
![]() ________________________________;
________________________________;
![]() ___________________________________;
___________________________________;
(2)依据名称写出物质:
3,4-二甲基-4-乙基庚烷 ______________;3,4,4-三甲基-1-戊炔 ______________。
(3)已知有机物降冰片二烯的分子结构可表示为:
①降冰片二烯的分子式为 ______________;②降冰片二烯属于 __________;
a.环烃 b.不饱和烃 c.烷烃 d.烯烃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向一定浓度的Na2C2O4溶液中滴加盐酸,混合溶液的pH与离子浓度变化关系如图所示。已知H2C2O4是二元弱酸,X表示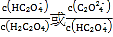 ,下列叙述错误的是
,下列叙述错误的是
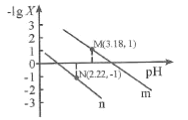
A.从M点到N点的过程中,c(H2C2O4)逐渐增大
B.直线n表示pH与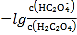 的关系
的关系
C.由N点可知Ka1 (H2C2O4)的数量级为10 -2
D.pH=4.18的混合溶液中:c(Na+)>c(HC2O4-)= c(C2O42-) =c(Cl-)> c(H+)>c(OH-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com