
【题目】写出下列有机物的类别及所含官能团的名称。
(1)CH3CH=CH2____、_________;
(2)HC≡C—CH2CH3__________、__________;
(3)![]() _________、___________;
_________、___________;
(4)![]() _________、_________;
_________、_________;
(5)![]() _________、___________;
_________、___________;
(6)CH3CH2—O—CH3__________、__________。
科目:高中化学 来源: 题型:
【题目】下列有关中和热概念、中和热测定实验(如图)的说法正确的是
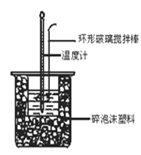
A.已知在稀溶液中:H+(aq)+OH-(aq) =H2O(l);ΔH=-57.3kJ·mol-1,则有![]() H2SO4(aq)+
H2SO4(aq)+![]() Ba(OH)2(aq)=
Ba(OH)2(aq)= ![]() BaSO4(s)+H2O(l) △H=-57.3kJ·mol-1
BaSO4(s)+H2O(l) △H=-57.3kJ·mol-1
B.已知2NaOH(aq)+H2SO4(aq)=Na2SO4(aq)+2H2O(l) △H=-114.6kJ·mol-1,则该反应的中和热为114.6 kJ·mol-1。
C.中和热测定实验过程中,环形玻璃搅拌棒材料若用铜代替,则测量出的中和热数值偏小
D.酸碱混合时,量筒中的NaOH溶液应分多次倒入已装有盐酸的小烧杯中,并不断用环形玻璃搅拌棒搅拌。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数的值,下列叙述不正确的是( )
A.60gSiO2晶体含4NA个σ键
B.78gNa2O2晶体中含有离子个数为4NA
C.在12g石墨中含CC共价键数目为1.5NA
D.CO和N2是等电子体,标况下22.4L的CO气体与1molN2所含的电子数相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,其中所列数字分别代表某一元素。

请你根据表中所给元素,回答下列问题:
(1)表中属于d区的元素是_________(填编号)。
(2)⑤⑥⑦三种元素中电负性最大的是_____(填写元素符号),在第二周期中第一电离能介于②和③之间的元素有_______种;
(3)元素⑨在周期表中的位置_______________。
(4)元素⑧和⑦能形成一种常见的干燥剂,它的电子式为_____________。
(5)写出下列有关反应的离子方程式:⑩的单质与元素③的最高价氧化物,对应的水化物的稀溶液反应:___________________________。
(6)⑥和⑦相比较,非金属性较弱的是______(填元素符号),可以验证你的结论的是下列中的_____(填编号)。
a.气态氢化物的稳定性; b.两元素的电负性;c.含氧酸的酸性; d. 最高化合价
(7)①与③的元素形成的10电子中性分子X的空间构型为_____,它极易溶于水中,请简要说明该物质易溶于水的原因_______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四种晶体的晶胞结构如图所示,下列有关说法正确的是( )
A.图甲所示晶体的化学式为A3B4C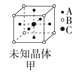
B.图乙所示晶体中阴阳离子个数比为1:1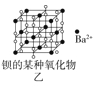
C.图丙所示CaF2晶体中Ca2+配位数为4,F-配位数为8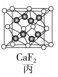
D.图丁所示晶体属于简单立方堆积
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)X射线衍射测定等发现,I3AsF6中存在I3+离子。I3+离子的几何构型为_____,中心原子的杂化类型为_____。
(2)CS2分子中,C原子的杂化轨道类型是_____。
(3)F2通入稀NaOH溶液中可生成OF2,OF2分子构型为_____,其中氧原子的杂化方式为_____。
(4)CH3COOH中C原子轨道杂化类型为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属钼在工业和国防建设中有重要的作用。钼(Mo)的常见化合价为+6、+5、+4。由钼精矿(主要成分是MoS2)可制备单质钼和钼酸钠晶体(Na2MoO4·2H2O),部分流程如图1所示:
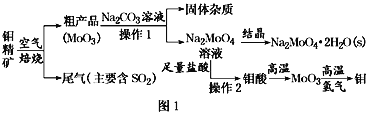
已知:钼酸微溶于水,可溶于液碱和氨水。
回答下列问题:
(1)焙烧钼精矿时发生的化学方程式为_____________________________。
(2)钼精矿焙烧时排放的尾气对环境的主要危害是___________________,请提出一种实验室除去该尾气的方法____________________________________。
(3)操作2的名称为________。由钼酸得到MoO3所用到的硅酸盐材料仪器的名称是________。
(4)焙烧钼精矿所用的装置是多层焙烧炉,图2为各炉层固体物料的物质的量的百分数(φ)。
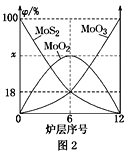
①x=________。
②焙烧炉中也会发生MoS2与MoO3反应生成MoO2和SO2的反应,若该反应转移6mol电子,则消耗的氧化剂的化学式及物质的量分别为________、________。
(5)操作1中,加入碳酸钠溶液充分反应后,碱浸液中c(MoO42-)=0.80mol·L1,c(SO42-)=0.04 mol·L1,在结晶前需加入Ba(OH)2固体以除去溶液中的SO42-。当BaMoO4开始沉淀时,SO42-的去除率是________。[Ksp(BaSO4)=1.1×1010、Ksp(BaMoO4)=4.0×108,溶液体积变化可忽略不计]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(14分)工业上常用苏打烧结法提取自然界中的稀散元素硒(Se),我国科研人员自主设计的利用粗铜电解精炼所产生含硒化亚铜(Cu2Se)和碲化亚铜(Cu2Te)的阳极泥为原料,提取硒的某种工艺流程如图所示。

回答下列问题:
(1)电解精炼铜时,电源的正极连接_______(填“粗铜”或“精铜”),阳极溶解铜的质量__________(填“>”“=”或“<”)阴极析出铜的质量。
(2)“烧结”时苏打和硒化亚铜主要生成了Na2SeO3、Cu2O和CO2气体,该反应的化学方程式为________________________________。“烧结”时生成了少部分Na2SeO4,写出“还原”时反应的离子方程式____________。
(3)含硒烧结物浸取时,最佳加热方式为________________,除去的物质为___________(填化学式)。
(4)本工艺副产物TeO2用于制造红外器件、声光器件材料,可溶于强酸和强碱,并形成复盐,则TeO2属于______氧化物(填“酸性”“碱性”或“两性”)。
(5)把硫酸工业第一步的产物SO2通入Na2SeO3溶液制备硒单质,写出该反应的离子方程式_____________。若得到50 kg硒单质,至少需要___________kg质量分数为90%的FeS2矿石。(结果保留一位小数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,将1.000mol/L盐酸滴入20.00mL1.000mol/L氨水中,溶液pH和温度随加入盐酸体积变化曲线如图所示。下列有关说法正确的是( )
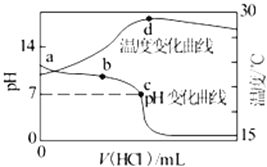
A.a点由水电离出的c(H+)=1.0×10-14mol/L
B.b点时c(NH4+)+c(NH3·H2O)>c(Cl-)
C.c点时消耗的盐酸体积:V(HCl)=20.00mL
D.d点后,溶液温度略下降的主要原因是NH3·H2O电离吸热
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com