
【题目】四种晶体的晶胞结构如图所示,下列有关说法正确的是( )
A.图甲所示晶体的化学式为A3B4C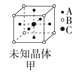
B.图乙所示晶体中阴阳离子个数比为1:1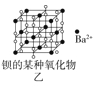
C.图丙所示CaF2晶体中Ca2+配位数为4,F-配位数为8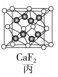
D.图丁所示晶体属于简单立方堆积
【答案】B
【解析】
A. 由图甲可知,A原子位于6个面心,6![]() 3;B位于8个顶点上,8
3;B位于8个顶点上,8![]() 1;C位于体心,只有1个。因此,所示晶体的化学式为A3BC,A不正确;
1;C位于体心,只有1个。因此,所示晶体的化学式为A3BC,A不正确;
B. 由图乙可知,每个Ba2+离子周围有6个![]() ,而每个
,而每个![]() 周围有6个Ba2+,因此,所示晶体中阴阳离子个数比为1:1,B正确;
周围有6个Ba2+,因此,所示晶体中阴阳离子个数比为1:1,B正确;
C. 由图丙可知,位于顶点和面心的是Ca2+,共有4个;位于体内的是F-,共有8个。位于相邻的4个所形成的正四面体的体心,因此,所示CaF2晶体中F-配位数为4,则Ca2+配位数为8, C不正确;
D. 图丁不能表示简单立方堆积,简单立方堆积的晶胞的体内没有原子,D不正确。
综上所述,有关说法正确的是B,故选B。


科目:高中化学 来源: 题型:
【题目】某温度下,在固定容积的密闭容器中,可逆反应A(g)+3B(g) ![]() 2C(g)达到平衡时,各物质的物质的量之比为n(A)∶n(B)∶n(C)=2∶2∶1。保持温度不变,以2∶2∶1的物质的量之比再充入A、B、C,则 ( )
2C(g)达到平衡时,各物质的物质的量之比为n(A)∶n(B)∶n(C)=2∶2∶1。保持温度不变,以2∶2∶1的物质的量之比再充入A、B、C,则 ( )
A. 平衡不移动
B. 再达平衡时,n(A)∶n(B)∶n(C)仍为2∶2∶1
C. 再达平衡时,C的体积分数增大
D. 再达平衡时,正反应速率增大,逆反应速率减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室以H2O2作氧化剂,在大量氨和氯化铵存在下,选择活性炭作为催化剂制备三氯化六氨合钴(III)配合物(活性的二价钴氨配合物氧化为惰性的三价钴氨配合物)的流程如下:

已知:Co(NH3)6Cl3在不同温度下水中的溶解度曲线如图。

(一)三氯化六氨合钴(III)配合物的制备
(1)步骤②中要冷却至10℃再缓慢地边搅拌边加入H2O2溶液,这样操作的目的是:________。
(2)实验室制备三氯化六氮合钴(III)总反应化学方程式为:_______________________。
(3)实验操作1为______________。操作2在[Co(NH3)6]Cl3溶液中加入浓盐酸的目的是____________________________________________。
(4)实验中用到减压抽滤装置如图,当抽滤完毕或中途停止抽滤时,应当采取的正确操作过程是_________________。
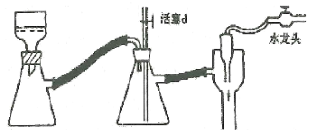
(二)产品中NH3含量的测定
现称取0.1000g产品,在三颈烧瓶中发生如下反应:
[Co(NH3)x]Cl3+3NaOH=Co(OH)3↓+xNH3↑+3NaCl(见下图),锥形瓶中装有10.00mL c mol·L-1 H2SO4,加热烧瓶,使NH3完全逸出。滴加2滴指示剂,用0.5000mol·L-1 NaOH标准溶液滴定,滴定达到终点时消耗NaOH溶液V mL。
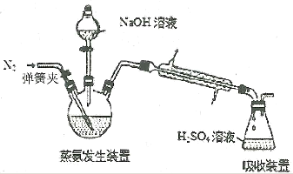
(5)下列关于实验的说法不正确的是______________。
A.第①步需在NH4Cl溶液中加入研细的CoCl2·6H2O晶体,目的是加速固体的溶解
B.原料NH4Cl的主要作用是抑制NH3·H2O的电离,有利于生成二价钴氨配合物,不形成Cu(OH)2
C.减压过滤涉及转移溶液,具体是:用倾析法先转移溶液,后开大水龙头,待溶液快流尽时再转移沉淀
D.第④步中使用含有盐酸的沸水,促进产品的析出
E.滴定时加入的2滴指示剂是酚酞
(6)根据实验(二)的数据计算:晶体中NH3的质量分数为__________(用含字母的式子表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下,将一盛有等体积NO、NO2的试管倒立在水槽中,充分反应后,下列叙述不正确的是(设试管中的溶质不往试管外扩散)
A.此反应中水既不是氧化剂又不是还原剂
B.试管内溶液中溶质的物质的量浓度为![]() mol/L
mol/L
C.溶液体积占试管容积的三分之二
D.若将试管中的气体换为氯化氢,则水充满试管
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2A ![]() B+C在某一温度时,达到平衡。
B+C在某一温度时,达到平衡。
(1)若温度升高,平衡向正反应方向移动,则正反应是________反应(填“放热”或“吸热”);
(2)若B为固体,减小压强平衡向逆反应方向移动,则A呈______态;
(3)若A、B、C均为气体,加入催化剂,平衡______移动(填“正向”、“逆向”或“不”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将16mLNO和NH3的混合气体在催化剂作用下,400℃左右发生下列反应:6NO+4NH3![]() 5N2+6H2O(g)。已知反应达平衡后,在相同条件下混合气体的体积变为17mL,则在原混合气体中,NO和NH3的物质的量之比可能是
5N2+6H2O(g)。已知反应达平衡后,在相同条件下混合气体的体积变为17mL,则在原混合气体中,NO和NH3的物质的量之比可能是![]()
![]()
①3:1②3:2③3:3 ④3:4 ⑤3:5
A.①②B.①⑤C.②③④D.④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应N2O4(g)![]() 2NO2(g) ΔH>0,平衡体系中总质量(m总)与总物质的量(n总)之比M(M=
2NO2(g) ΔH>0,平衡体系中总质量(m总)与总物质的量(n总)之比M(M=![]() )在同温度下随压强的变化曲线如图所示。下列说法正确的是:
)在同温度下随压强的变化曲线如图所示。下列说法正确的是:
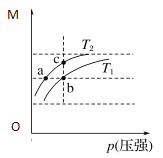
A. 温度:T1<T2
B. 平衡常数:K(a)=K(b)<K(c)
C. 反应速率:vb<va
D. 当M=69 g·mol-1时,n(NO2)∶n(N2O4)=1∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】全球气候变暖给人类的生存和发展带来了严峻的挑战,在此背景下,“新能源”、“低碳”、“节能减排”、“吃干榨尽”等概念愈来愈受到人们的重视。下列有关说法不正确的是
A. 太阳能、地热能、生物质能和核聚变能均属于“新能源”
B. “低碳”是指采用含碳量低的烃类作为燃料
C. 如图甲烷经一氯甲烷生成低碳烯烃的途径体现了“节能减排”思想

D. 让煤变成合成气,把煤“吃干榨尽”,实现了煤的清洁、高效利用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物的知识贯穿整个高中学习,通过《化学反应原理》这本书的学习更是加深了对它们的认识。
(1)亚磷酸是二元弱酸。已知:
![]()
![]()
![]()
求![]()
![]()
![]() ______________
______________
(2)亚磷酸溶液与硝酸银溶液混合生成单质银和NO,写出该反应的离子方程式_________
(3)关于![]() 溶液,下列表达正确的是_____
溶液,下列表达正确的是_____
A.![]()
B.![]()
C.![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com