
【题目】请写出下列各题中的离子方程式或化学方程式
(1)碳酸钠与硝酸反应的离子方程式:_________。
(2)二氧化硅与氢氧化钠反应的离子方程式:_____________。
(3)写出工业制硅所涉及的化学方程式:a.__________b.__________c.____________。
(4)写出氢氧化镁与盐酸反应的离子方程式:____________。
(5)请写出一个离子方程式证明溴的氧化性大于碘:_________。
(6)写出一个化学方程式其离子反应为CO32-+2H+=CO2+H2O:______。
(7)写出一种酸在常温下能与硅反应的化学方程式:_______________。
(8)写出用HF雕刻玻璃的化学方程式:_________________。
【答案】CO32-+2H+=CO2↑+H2O SiO2+2OHˉ=SiO32ˉ+H2O SiO2+2C![]() Si+2CO↑ Si(粗)+2Cl2
Si+2CO↑ Si(粗)+2Cl2![]() SiCl4 SiCl4+2H2
SiCl4 SiCl4+2H2![]() Si(纯)+4HCl Mg(OH)2+2H+=Mg2++2H2O Br2+2I-=2Br-+I2 Na2CO3+2HCl=2NaCl+H2O+CO2↑ Si+4HF=SiF4↑+2H2↑ SiO2+4HF=SiF4↑+2H2O
Si(纯)+4HCl Mg(OH)2+2H+=Mg2++2H2O Br2+2I-=2Br-+I2 Na2CO3+2HCl=2NaCl+H2O+CO2↑ Si+4HF=SiF4↑+2H2↑ SiO2+4HF=SiF4↑+2H2O
【解析】
(1)碳酸钠是易溶于水易电离的电解质,硝酸是强酸,在水溶液中全部电离,碳酸钠溶液与硝酸反应生成硝酸钠、水、二氧化碳,离子反应为CO32-+2H+=CO2↑+H2O;答案为:CO32-+2H+=CO2↑+H2O。
(2)二氧化硅是难溶物,在离子方程式保留化学式,二氧化硅与氢氧化钠溶液反应生成硅酸钠和水,反应的离子方程式为:SiO2+2OHˉ=SiO32ˉ+H2O;答案为SiO2+2OHˉ=SiO32ˉ+H2O。
(3)工业上利用二氧化碳与碳在高温下反应生产粗硅,反应的化学方程式为:SiO2+2C ![]() Si+2CO↑,粗硅提纯的方程式为:Si(粗)+2Cl2
Si+2CO↑,粗硅提纯的方程式为:Si(粗)+2Cl2![]() SiCl4;SiCl4+2H2
SiCl4;SiCl4+2H2![]() Si(纯)+4HCl;答案为SiO2+2C
Si(纯)+4HCl;答案为SiO2+2C![]() Si+2CO↑,Si(粗)+2Cl2
Si+2CO↑,Si(粗)+2Cl2![]() SiCl4;SiCl4+2H2
SiCl4;SiCl4+2H2![]() Si(纯)+4HCl。
Si(纯)+4HCl。
(4)氢氧化镁是难溶物,在离子方程式保留化学式,氢氧化镁与稀盐酸反应生成氯化镁和水,离子方程式为Mg(OH)2+2H+=Mg2++2H2O;答案为Mg(OH)2+2H+=Mg2++2H2O。
(5)为验证溴的氧化性强于碘,将溴加入到盛有KI的溶液中,能置换出碘,就可证明,反应的离子方程式为Br2+2I-=2Br-+I2;答案为Br2+2I-=2Br-+I2。
(6)CO32-+2H+=H2O+CO2↑表示可溶性碳酸盐与强酸反应生成可溶性盐和二氧化碳、水的一类反应,如:Na2CO3+2HCl=2NaCl+H2O+CO2↑;答案为Na2CO3+2HCl=2NaCl+H2O+CO2↑。
(7)Si与氢氟酸反应生成氢气和四氟化硅,Si+4HF=SiF4↑+2H2↑;答案为Si+4HF=SiF4↑+2H2↑。
(8)HF雕刻玻璃,其实质是HF与玻璃中的二氧化硅反应生成四氟化硅和水,反应方程式为SiO2+4HF=SiF4↑+2H2O;答案为SiO2+4HF=SiF4↑+2H2O。


科目:高中化学 来源: 题型:
【题目】下列离子方程式书写错误的是
A. 铝粉投入到NaOH溶液中:2Al+2H2O+2OH-=2AlO2-+3H2↑
B. Al(OH)3溶于NaOH溶液中:Al(OH)3 +OH-=AlO2- +2H2O
C. 碳酸氢钠水解: HCO3-+H2O![]() OH-+CO2↑+H2O
OH-+CO2↑+H2O
D. FeCl2溶液中通入Cl2:2Fe2++Cl2 =2Fe3++2Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图装置模拟铁的电化学保护。下列说法正确的是
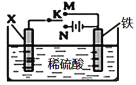
A.若X为锌棒,开关K置于M处,为外加电流阴极保护法
B.若X为碳棒,开关K置于N处,为牺牲阳极阴极保护法
C.若X为锌棒,开关K置于M处,Zn极发生:Zn-2e→Zn2+
D.若X为碳棒,开关K置于N处,X极发生还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个2L的密闭容器中,发生反应: 2SO3 (g)![]() 2SO2 (g)+ O2 (g) — Q (Q>0),其中SO3的物质的量随时间变化如图所示,下列判断错误的是
2SO2 (g)+ O2 (g) — Q (Q>0),其中SO3的物质的量随时间变化如图所示,下列判断错误的是

A. 0~8min内v(SO3)=0.025mol/(L·min)
B. 8min时,v逆(SO2)=2v正(O2)
C. 8min时,容器内压强保持不变
D. 若8min时将容器压缩为1L,n(SO3)的变化如图中a
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[Zn(CN)4]2-在水溶液中与HCHO发生如下反应:4HCHO+[Zn(CN)4]2+4H++4H2O= [Zn(H2O)4]2++4HOCH2CN,HOCH2CN的结构简式如下图所示,下列说法不正确的是
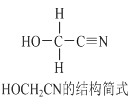
A. HOCH2CN分子中没有手性碳原子
B. 1mol HOCH2CN分子中含有σ键的物质的量为5mol
C. [Zn(CN)4]2-和[Zn(H2O)4]2+的中心原子配位数均为4
D. HOCH2CN分子中碳原子轨道的杂化类型分别是sp3和sp杂化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列各装置图的叙述中,正确的是
A. 制取及观察Fe(OH)2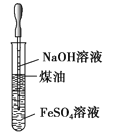
B. 比较两种物质的热稳定性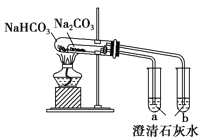
C. 实验室制取NH3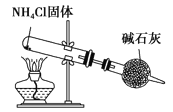
D. 分离沸点不同且互溶的液体混合物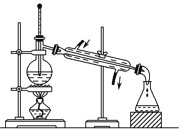
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有一瓶签上注明为葡萄糖酸盐(钠、镁、钙、铁)的复合制剂,某同学为了确认其成分,取部分制剂作为试液,设计并完成了如下实验:

已知:控制溶液pH=4时,Fe(OH)3沉淀完全,Ca2+、Mg2+不沉淀。
该同学得出的结论正确的是
A. 根据现象1可推出该试液中含有Na+
B. 根据现象2可推出该试液中并不含有葡萄糖酸根
C. 根据现象3和4可推出该试液中含有Ca2+,但没有Mg2+
D. 根据现象5可推出该试液中一定含有Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组探究铝与稀盐酸反应速率的影响因素,用等质量的铝和等体积、等浓度的足量稀盐酸反应,得到的3组实验数据如下:
实验编号 | 铝的形状 | 反应温度/℃ | 收集100mLH2所需的时间 |
① | 铝粉 | 20 | 21 |
② | 铝片 | 20 | 82 |
③ | 铝片 | 30 | 35 |
回答下列问题:
(1)写出铝与稀盐酸反应的化学方程式______________________。
(2)探究温度对该反应速率影响的对比实验是③和_______ (填实验编号),得出的实验结论是________。
(3)若将该实验中“收集100mL H2所需时间改为“测量相同时间内生成H2的体积”,可选用的排水量气装置为下图中的______________(填装置代号)。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com