
【题目】化工生产中含Cu2+的废水常用MnS(s)作沉淀剂,其反应原理为Cu2+(aq)+MnS(s)![]() CuS(s)+Mn2+(aq)。下列有关该反应的推理不正确的是
CuS(s)+Mn2+(aq)。下列有关该反应的推理不正确的是
A.MnS的溶解度比CuS的溶解度大
B.该反应达到平衡时,c(Cu2+)=c(Mn2+)
C.向上述平衡体系中加入少量CuSO4固体后,c(Mn2+)变大
D.该反应平衡常数K=![]()
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】如图是一个化学过程的示意图。
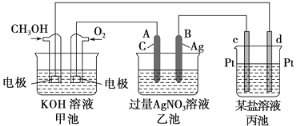
请回答:
(1)甲池是________池,通入O2的一极电极反应式为__________________,该电池的总反应方程式为______________。
(2)乙池中A电极名称为________极,电极反应式为__________________。一段时间后溶液的pH________(填“增大”、“减小”或“不变”)。
(3)当乙池中B(Ag)极的质量增加5.40 g时,甲池中理论上消耗O2________mL(标准状况下)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,用0.100mol·L-1的NaOH溶液滴定20.00mL0.100mol·L-1的HA溶液,溶液的pH与所加NaOH溶液体积(V)的关系如图所示。下列说法不正确的是
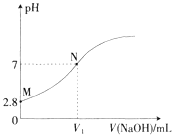
A. V1<20
B. Ka(HA)的数量级为10-5
C. M点溶液加少量水稀释,![]() 增大
增大
D. N点后,随着NaOH溶液的加入,溶液中水的电离程度逐渐增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设![]() 表示阿伏加德罗常数的值,下列说法正确的是
表示阿伏加德罗常数的值,下列说法正确的是
A.标准状况下,将![]() 通入足量水中,生成
通入足量水中,生成![]() 的分子数为
的分子数为![]()
B.铁与稀硝酸反应生成的气体产物仅有![]() ,转移的电子数一定为
,转移的电子数一定为![]()
C.15g乙烷与1mol氯气充分反应,所得有机物中含有的氯原子数为![]()
D.![]() 中含有的质子数和中子数均为
中含有的质子数和中子数均为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设![]() 为阿伏加德罗常数的值。下列说法正确的是( )
为阿伏加德罗常数的值。下列说法正确的是( )
A.标准状况下,![]() 苯中含有
苯中含有![]() 个苯分子
个苯分子
B.标准状况下,![]() 分别与足量的铁和铜充分反应,转移的电子总数之比为
分别与足量的铁和铜充分反应,转移的电子总数之比为![]()
C.![]() 溶液中,阳离子和阴离子的数目之比为
溶液中,阳离子和阴离子的数目之比为![]()
D.![]() 中含有的共价键数为
中含有的共价键数为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃、101 kPa下,2g氢气燃烧生成液态水,放出285.8kJ热量,表示该反应的热化学方程式正确的是( )
A. 2H2(g)+O2(g) == 2H2O(1) △H= ―285.8kJ/mol![]()
B. 2H2(g)+ O2(g) == 2H2O(1) △H= +571.6 kJ/mol
C. 2H2(g)+O2(g) == 2H2O(g) △H= ―571.6 kJ/mol
D. H2(g)+1/2O2(g) == H2O(1) △H= ―285.8kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在固定容积的密闭容器中,可逆反应:mA(g)+nB(g)![]() pCg)+qD(g),当m、n、p、q为任意正整数时,下列状态:①体系的压强不再发生变化,②体系的密度不再发生变化,③各组分的物质的量浓度不再改变,④各组分的质量分数不再改变,⑤反应速率vA:vB:vC:vD=m:n:p:q,其中,能说明反应已达到平衡的是( )
pCg)+qD(g),当m、n、p、q为任意正整数时,下列状态:①体系的压强不再发生变化,②体系的密度不再发生变化,③各组分的物质的量浓度不再改变,④各组分的质量分数不再改变,⑤反应速率vA:vB:vC:vD=m:n:p:q,其中,能说明反应已达到平衡的是( )
A.只有③④B.②③④C.①②③④D.①②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】50mL 18mol/L的硫酸中加入足量的铜片并加热,被还原的硫酸的物质的量
A. 小于0.45mo1B. 等于0.45molC. 在0.45mol和0.9mol之间D. 大于0.9mo1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙二酸(HOOC—COOH)俗名草酸,是一种有还原性的有机弱酸,在化学上有广泛应用。
(1)小刚在做“研究温度对化学反应速率的影响”实验时,他往A、B两支试管中均加入4 mL 0.01 mol·L-1的酸性KMnO4溶液和2 mL 0.1 mol·L-1H2C2O4(乙二酸)溶液,振荡,A试管置于热水中,B试管置于冷水中,记录溶液褪色所需的时间。褪色所需时间tA________tB(填“>”“=”或“<”)。
(2)实验室有一瓶混有泥沙的乙二酸样品,小刚利用如下反应原理:2KMnO4+5H2C2O4+6H2SO4=10CO2↑+2MnSO4+8H2O来测定样品中乙二酸含量,具体操作为:
①配制250 mL溶液:准确称量5.000 g乙二酸样品,配成250 mL溶液。配制溶液除胶头滴管外,还需要的玻璃仪器有_________________。
②滴定:准确量取25.00 mL所配溶液于锥形瓶中加少量酸酸化,将0.1000 mol·L-1KMnO4标准溶液装入______(填“酸式”或“碱式”)滴定管,进行滴定操作。滴定达到终点的判断方法是___________。
③计算:重复上述操作2次,记录实验数据如下表,计算此样品的纯度为____________。
序号 | 滴定前读数 | 滴定后读数 |
1 | 0.00 | 20.01 |
2 | 1.00 | 20.99 |
3 | 0.00 | 21.10 |
④ 误差下列操作会导致测定结果偏高的是______。
a.未用KMnO4标准溶液润洗滴定管
b.滴定前锥形瓶内有少量水
c.滴定前滴定管尖嘴部分有气泡,滴定后气泡消失
d.观察读数时,滴定前仰视,滴定后俯视
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com