
【题目】25℃时,用0.100mol·L-1的NaOH溶液滴定20.00mL0.100mol·L-1的HA溶液,溶液的pH与所加NaOH溶液体积(V)的关系如图所示。下列说法不正确的是
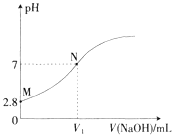
A. V1<20
B. Ka(HA)的数量级为10-5
C. M点溶液加少量水稀释,![]() 增大
增大
D. N点后,随着NaOH溶液的加入,溶液中水的电离程度逐渐增大
科目:高中化学 来源: 题型:
【题目】某磁黄铁矿的主要成分是FexS(S为-2价),既含有Fe2+,又含有Fe3+,将一定量的该磁黄铁矿与100mL的盐酸恰好完全反应(注:矿石中其他成分不与盐酸反应),生成2.4g硫单质,0.425mol FeCl2 和一定量H2S气体,且溶液中无Fe3+。则下列说法正确的是
A. 该盐酸的物质的量浓度为4.25mol·L-1
B. 该磁黄铁矿FexS中,Fe2+与Fe3+的物质的量之比为3∶1
C. 成的H2S气体在标准状况下的体积为2.24L
D. 该磁黄铁矿中FexS的x=0.85
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现用传感技术测定喷泉实验中的压强变化来认识喷泉实验的原理。下列说法正确的是

A. 制取氨气时烧瓶中的固体常用CaO或CaCl2
B. 将湿润的蓝色石蕊试纸置于三颈瓶口,试纸变红,说明NH3已经集满
C. 关闭a,将单孔塞(插有吸入水的胶头滴管)塞紧颈口c,打开b,完成喷泉实验,电脑绘制三颈瓶内压强变化曲线如图2,则E点时喷泉最剧烈
D. 工业上,若出现液氨泄漏,喷稀盐酸比喷洒NaHCO3溶液处理效果好
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化钙(Ca3N2)氮化钙是一种棕色粉末,在空气中氧化,遇水会发生水解,生成氢氧化钙并放出氨。某化学兴趣小组设计制备氮化钙并测定其纯度的实验如下:
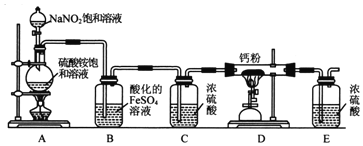
Ⅰ.氮化钙的制备
(1)连接装置后,检查整套装置气密性的方法是_____________________。
(2)装置A中每生成标准状况下4.48LN2,转移的电子数为___________________。
(3)装置B的作用是吸收氧气,则B中发生反应的离子方程式为__________。装置E的作用是______________________。
(4)实验步骤如下:检查装置气密性后,装入药品;_____________________(请按正确的顺序填入下列步骤的代号)。
①加热D处的酒精喷灯; ②打开分液漏斗活塞; ③加热A处的酒精灯;④停上加热A处的酒精灯;⑤停止加热D处的酒精喷灯
(5)请用化学方法确定氮化钙中含有未反应的钙,写出实验操作及现象___________。
Ⅱ.测定氮化钙的纯度:
①称取4.0g反应后的固体,加入足量水,将生成的气体全部蒸出并通入100.00mL1.00mol·L-1盐酸中,充分反应后,将所得溶液稀释至200.00mL;
②取20.00mL稀释后的溶液,用0.20mol·L-1NaOH标准溶液滴定过量的盐酸,达到滴定终点时,消耗标准溶液25.00mL。
(1)氮化钙的质量分数为_________。
(2)达到滴定终点时,仰视滴定管读数将使测定结果_________(填“偏高”、“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是采用新能源储能器件将CO2转化为固体产物,实现CO2的固定和储能灵活应用的装置。储能器件使用Li-CO2电池,组成为:钌电极/CO2饱和的LiClO4-DMSO电解液/锂片。下列说法不正确的是

A. Li-CO2电池的电解液由LiClO4和DMSO溶于水得到
B. CO2的固定中,每转移8 mol e-,生成6 mol气体
C. 过程Ⅱ中化学能转化为电能
D. 过程Ⅰ的钌电极的电极反应式为2Li2CO3+C-4e-═4Li++3CO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验小组探究甲烷与氯气的取代反应,装置、现象如下:
现象 |
ⅰ.光照后,产生白雾,混合气体颜色变浅 ⅱ.试管内液面上升至试管的2/3;试管壁和液面上出现少量油状液滴 |

下列说法不正确的是
A. 饱和食盐水可以减少氯气的溶解
B. 油状液滴的主要成分是一氯甲烷
C. 产生白雾以及试管内液面上升证明有氯化氢生成
D. 为了探究反应条件,可用黑色纸套套住装满甲烷和氯气的试管,一段时间后进行观察
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫代硫酸钠俗称“海波”,又名“大苏打”,溶液具有弱碱性和较强的还原性,是棉织物漂白后的脱氯剂,定量分析中的还原剂。硫代硫酸钠(Na2S2O3)可由亚硫酸钠和硫粉通过化合反应制得,装置如图a所示。

已知:Na2S2O3在酸性溶液中不能稳定存在,有关物质的溶解度曲线如图b所示,
(1)Na2S2O3·5H2O的制备:
步骤1:如图连接好装置后,检查A、C装置气密性的操作是____________________。
步骤2:加入药品,打开K1、关闭K2,加热。装置B、D中的药品可选用下列物质中的_________。(填编号)
A.NaOH溶液 B.浓H2SO4 C.酸性KMnO4溶液 D.饱和NaHCO3溶液
步骤3:C中混合液被气流搅动,反应一段时间后,硫粉的量逐渐减少。当C中溶液的pH在7—10时,打开K2、关闭K1并停止加热;C中溶液要控制pH的原因是____________。
步骤4:过滤C中的混合液,将滤液经过加热浓缩,趁热过滤,再将滤液__________、过滤、________、烘干,得到产品。
(2)Na2S2O3性质的检验:
向足量的新制氯水中滴加少量Na2S2O3溶液,氯水颜色变浅,检验反应后溶液中含有硫酸根,写出该反应的化学方程式____________________________________________。
(3)常用Na2S2O3溶液测定废水中Ba2+浓度,步骤如下:取废水25.00 mL,控制适当的酸度加入足量K2Cr2O7溶液,得BaCrO4沉淀;过滤、洗涤后,用适量稀盐酸溶解.此时CrO42-全部转化为Cr2O72-;再加过量KI溶液,充分反应后,加入淀粉溶液作指示剂,用0.010 mol·L-1的Na2S2O3溶液进行滴定,反应完全时,消耗Na2S2O3溶液18.00 mL。部分反应的离子方程式为:Cr2O72-+6I-+14H+=3I2+2Cr3++3I2+7H2O I2+2S2O32-=S4O62-+2I-,则该废水中Ba2+的物质的量浓度为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关合金的叙述中正确的是( )
A.合金的密度比各成分金属小
B.合金的抗腐蚀性能都很好
C.合金的导电性比各成分金属强
D.合金的种类和性能与成分有关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计的微型实验装置验证SO2的性质,通过分析实验,下列结论表达正确的是

A. a棉球褪色,验证SO2具有氧化性
B. b棉球褪色,验证SO2具有酸性氧化物的通性
C. c棉球蓝色褪去,验证SO2漂白性
D. 可以使用浓硫酸吸收尾气
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com