
【题目】[化学—选修3:物质结构与性质]
硼、碳、镓、砷、硒的化合物被广泛应用于新材料制备、生活生产等诸多领域。根据物质结构相关知识,回答下列问题:
(1)第四周期镓、砷、硒三种元素中,第一电离能由大到小顺序为___________,电负性由大到小顺序为___________(用元素符号填写)
(2)元素氮与砷同族。基态氮元素的价电子排布式为______,预测砷的氢化物分子的立体结构为_____,其沸点比NH3的_____(填“高”或“低”),其判断理由是_________。
(3)硼及化合物应用广泛。
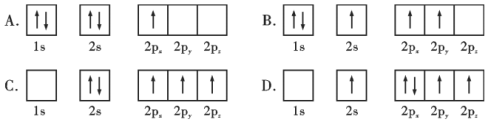
①下列硼原子电子排布图表示的状态中,能量最低和最高的分别为___________、___________(填标号)
②晶体硼单质能自发呈现出正二十面体的多面体外形,这种性质称为晶体的___________。
③已知BP的熔点很高,其晶胞结构如下图所示。
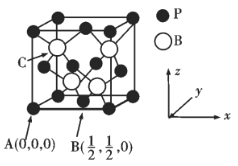
C点的原子坐标为___________,B原子与P原子的最近距离为dpm,晶体的密度为pg/cm3,NA代表阿伏加德罗常数的值,则ρ=___________g/cm3(用含d、NA的代数式表示)
【答案】As>Se>Ga Se>As>Ga 2s22p3 三角锥形 低 NH3分子间存在氢键 A D 自范性 ![]()
【解析】
(1)As的4p能级含有3个电子,为半满稳定状态,第一电离能较相邻元素高;非金属性越强,电负性越大;
(2)氮元素于元素周期表第二周期VA族;AsH3分子中As原子的价层电子对数为4,孤对电子数为1;NH3分子间可以形成氢键;
(3)①电子处于激发态时能量较高;
②在适宜的条件下,晶体能够自发地呈现封闭的、规则的多面体外形,这称为晶体的自范性;
③由晶胞结构示意图可知B原子位于体对角线的![]() 处;依据分摊法计算晶胞的密度。
处;依据分摊法计算晶胞的密度。
(1)同周期元素从左到右,元素第一电离能逐渐增大,但As的4p能级含有3个电子,为半满稳定状态,第一电离能较相邻元素高,则第一电离能的大小顺序为As>Se>Ga;同周期元素从左到右,非金属性依次增强,电负性依次增大,则电负性的大小顺序为Se>As>Ga,故答案为:As>Se>Ga;Se>As>Ga;
(2)氮元素于元素周期表第二周期VA族,价电子排布式为2s22p3;砷的氢化物为AsH3,分子中As原子的价层电子对数为4,孤对电子数为1,则As原子为sp3杂化,AsH3的立体结构为三角锥形;NH3分子间可以形成氢键,增大了分子间作用力,熔沸点增大,则NH3的沸点高于AsH3,故答案为:2s22p3;三角锥形;低;NH3分子间存在氢键;
(3)①电子处于激发态时能量较高,由图可知,A为B原子的电子排布图,符合能量最低原理,能量最低;B中B原子2s轨道上有1个电子跃迁到2p轨道,有1个电子处于激发态,C中1s轨道上有2个电子跃迁到2p轨道,有2个电子处于激发态,D中1s轨道上有2个电子,2s轨道上有1个电子跃迁到2p轨道,有3个电子处于激发态,则D能量最高,故答案为:A;D;
②在适宜的条件下,晶体能够自发地呈现封闭的、规则的多面体外形,这称为晶体的自范性,则晶体硼单质能自发呈现出正二十面体的多面体外形为晶体的自范性,故答案为:自范性;
③由晶胞结构示意图可知P位于顶点(0,0,0)和面心(![]() ,
,![]() ,0),B原子位于体对角线的
,0),B原子位于体对角线的![]() 处,则C点B原子坐标为(
处,则C点B原子坐标为(![]() ,
,![]() ,
,![]() );晶胞中P原子的数目为(8×
);晶胞中P原子的数目为(8×![]() +6×
+6×![]() )=4,B原子数目为4,晶胞的质量为
)=4,B原子数目为4,晶胞的质量为![]() g,B原子与P原子的最近距离为d×10—10cm,则体对角线的长度为4d×10—10cm,晶胞的变成为
g,B原子与P原子的最近距离为d×10—10cm,则体对角线的长度为4d×10—10cm,晶胞的变成为![]() d×10—10cm,由(
d×10—10cm,由(![]() d×10—10cm)3ρ=
d×10—10cm)3ρ=![]() 可得ρ=
可得ρ=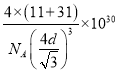 g/cm3,故答案为:(
g/cm3,故答案为:(![]() ,
,![]() ,
,![]() );
);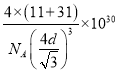 。
。


科目:高中化学 来源: 题型:
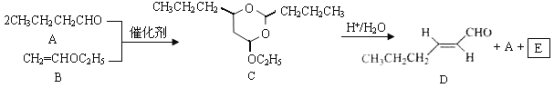
【题目】反-2-己烯醛(D)是一种重要的合成香料,下列合成路线是制备D的方法之一。根据该合成路线回答下列问题:
已知: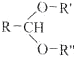
![]() RCHO+R'OH+R"OH
RCHO+R'OH+R"OH
(1)A的名称是__________;B分子中共面原子数目最多为__________;C分子中与环相连的三个基团中,不同化学环境的氢原子共有__________种。
(2)D中含氧官能团的名称是__________,写出检验该官能团的化学反应方程式:__________。
(3)E为有机物,能发生的反应有__________。
a.聚合反应b.加成反应c.消去反应d.取代反应
(4)B的同分异构体F与B有完全相同的官能团,写出F所有可能的结构:________。
(5)以D为主要原料制备己醛(目标化合物),在方框中将合成路线的后半部分补充完整。
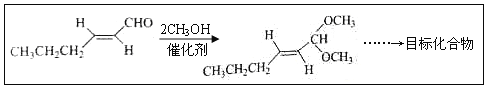
(6)问题(5)的合成路线中第一步反应的目的是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组欲利用如图所示的实验装置探究苯与液溴的反应(装置连接顺序为CDAB)
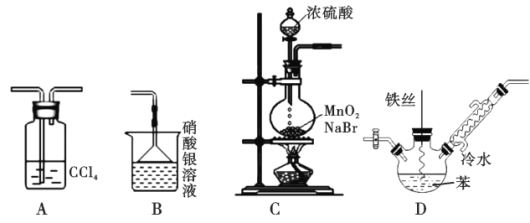
已知:MnO2+2NaBr+2H2SO4![]() Br2↑+MnSO4+Na2SO4+2H2O,下列说法不正确的是
Br2↑+MnSO4+Na2SO4+2H2O,下列说法不正确的是
A. 装置A的作用是除去HBr中的溴蒸气
B. 装置B的作用是检验HBr
C. 可以用装置C制取溴蒸气
D. 装置D反应后的混合液经稀碱溶液洗涤、结晶,得到溴苯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】支撑海港码头基础的钢管柱,常用外加电流的阴极保护法进行防腐,工作原理如图所示,其中高硅铸铁为惰性辅助阳极。下列有关表述不正确的是

A. 通入保护电流使钢管桩表面腐蚀电流接近于零
B. 通电后外电路电子被强制从高硅铸铁流向钢管桩
C. 高硅铸铁的作用是作为损耗阳极材料和传递电流
D. 通入的保护电流应该根据环境条件变化进行调整
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上可由乙苯生产苯乙烯: ,下列说法正确的是
,下列说法正确的是
A. 该反应的类型为消去反应
B. 乙苯的同分异构体共有三种
C. 可用Br2/CCl4鉴别乙苯和苯乙烯
D. 乙苯和苯乙烯分子内共平面的碳原子数均为7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水热法制备Fe3O4纳米颗粒的总反应为:3Fe2++2S2O32-+O2+XOH- =Fe3O4+S4O62-+2H2O,下列说法正确的是( )
A. 硫元素被氧化,铁元素被还原
B. Fe2+、S2O32- 都是还原剂
C. X=2
D. 每生成1mol Fe3O4,则转移电子数2mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在通风橱中进行下列实验:
步骤 |
|
| |
现象 | Fe表面产生大量无色气泡,液面上方变为红棕色 | Fe表面产生少量红棕色 气泡后,迅速停止 | Fe、Cu接触后,其表面 均产生红棕色气泡 |
下列说法中,不正确的是( )
A.Ⅰ中气体由无色变红棕色的化学方程式为:2NO+O2=2NO2
B.Ⅱ中的现象说明Fe表面形成致密的氧化层,阻止Fe进一步反应
C.对比Ⅰ、Ⅱ中现象,说明稀HNO3的氧化性强于浓HNO3
D.针对Ⅲ中现象,在Fe、Cu之间连接电流计,可判断Fe是否持续被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】叠氮化钠(NaN3)可用于汽车安全气囊的产气药。一种由氨基化钠(NaNH2)制备NaN3的工艺流程如下:
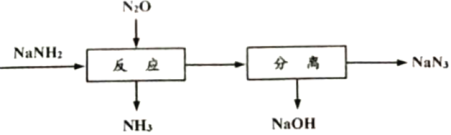
(1)生产NaNH2的化学方程式为2Na+ 2NH3(液)= 2NaNH2+ H2↑。
①钠元素位于周期表第___________周期___________族。
②NaNH2中氮元素的化合价为___________.
(2) NaOH的电子式为___________, 流程中“反应”的化学方程式为___________。
(3) NaN3晶体属于_____________(填 “离子”、“分子”或“原子”)晶体,NaN3在撞击时能发生分解反应生成两种单质。计算理论上65gNaN3完全分解,释放出标准状况下的气体体积_________(写出计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2和NaClO2均具有漂白性,工业上用ClO2气体制NaClO2的工艺流程如图所示:
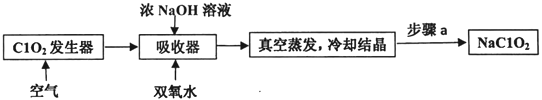
下列说法不正确的是( )
A.步骤a的操作包括过滤、洗涤和干燥
B.通入空气的目的是驱赶出ClO2,使其被吸收器充分吸收
C.工业上可将ClO2制成NaClO2固体,便于贮存和运输
D.吸收器中生成NaClO2的离子方程式:2ClO2+H2O2=2C1O2- -+O2↑+2H+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com