
【题目】在恒定温度下使NH2COONH4(s)![]() 2NH3(g)+CO2(g)达到平衡,不能判断该反应已经达到平衡状态的是
2NH3(g)+CO2(g)达到平衡,不能判断该反应已经达到平衡状态的是
A. v正(NH3)=2v逆(CO2) B. 密闭容器中总压强不变
C. 密闭容器中混合气体的密度不变 D. 密闭容器中氨气的体积分数不变
科目:高中化学 来源: 题型:
【题目】随原子序数递增,八种短周期元素(用字母x表示)原子半径的相对大小、最高正价或最低负价的变化如下图所示。

根据判断回答下列问题:
(1)f在周期表中的位置是__________。
(2)比较d、e常见离子的半径大小(用化学式表示,下同):____>____;比较g、h的最高价氧化物对应水化物的酸性强弱:____>____。
(3)任选上述元素组成一种四原子共价化合物,写出其电子式:________。
(4)写出e的单质在足量d2中燃烧反应的化学方程式:________________。
(5)上述元素可组成盐R:zx4f(gd4)2。向盛有10 mL 1 mol·L-1R溶液的烧杯中滴加1 mol·L-1NaOH溶液,沉淀物质的量随NaOH溶液体积的变化示意图如下:

①写出m点反应的离子方程式:___________________。
②若在R溶液中改加20 mL 1.2 mol·L-1Ba(OH)2溶液,充分反应后,溶液中产生沉淀的物质的量为____mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】位于前四周期的8种元素A、B、C、D、E、F、G、H的原子序数依次增大,其中A是所有原子中原子半径最小的,且与B同族,C的基态原子2P能级上只有1个电子,F可与A可按原子个数比1∶1和1∶2形成化合物;F与G同族,H的原子序数为29,根据上述信息描述,请回答下列问题:
(1)请写出上述8种元素中电负性最大的元素与B元素形成常见的化合物的化学式___(用具体元素符号表示的化学式),写出基态原子的第一电离能最大的元素在周期表中的位置为___。
(2)写出H的原子在基态时的核外电子排布式为_________。
(3)1mol D2A6分子(链状)中含有![]() 键的数目为________。
键的数目为________。
(4)已知A2F2分子结构如图a所示,则其中心原子杂化轨道类型为________。

(5)判断A2F2____(填难或易)溶于DG2,并简要说明原因_____________________。
(6)C与E形成某化合物的晶胞如图 b所示,则处于晶胞顶角上的原子的配位数为_______,若该化合物的密度为![]() g·cm-3,阿伏加德罗常数为NA,则两个最近E原子间的距离为____ pm(用含
g·cm-3,阿伏加德罗常数为NA,则两个最近E原子间的距离为____ pm(用含![]() 、NA的代数式表示)。
、NA的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于铵盐的描述都正确的是
①都溶于水 ②都是白色晶体 ③都有刺激性气味 ④加热后都有氨气放出 ⑤与碱混合后加热都有氨气放出 ⑥都能使石蕊试纸变蓝
A. 全部B. ①②⑤⑥C. ①②⑤D. ③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机化合物种类繁多,性质各异。下列有关常见有机物的描述中正确的是
A. 所有的糖、油脂、蛋白质在一定条件下均能发生水解反应
B. 苯、溴苯、硝基苯、乙酸乙酯均不溶于水
C. 用NaOH溶液不能区分![]() 和CH3COOCH2CH3
和CH3COOCH2CH3
D. 与Na反应的剧烈程度:CH3COOH>CH3CH2OH>H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列叙述中正确的是
A. 0.25mol Na2O2中含有的阴离子数为0.5NA
B. 等物质的量的OH-与羟基(-OH)所含电子数相等
C. 惰性电极电解食盐水,若电路中通过NA个电子,则标况下阳极产生气体11.2L
D. 25℃时,pH=13的1.0L Ba(OH)2溶液中含OH-数目为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据报导,我国已研制出“可充室温钠一二氧化碳电池”,电极材料为钠金属片和碳纳米管,电解液为高氯酸钠一四甘醇二甲醚,电池总反应为:4Na+3CO2![]() 2Na2CO3+C,生成固体Na2CO3沉积在碳纳米管上。下列叙述不正确的是
2Na2CO3+C,生成固体Na2CO3沉积在碳纳米管上。下列叙述不正确的是
A. 放电时钠金属片发生氧化反应
B. 充电时碳纳米管接直流电源的正极
C. 放电时每消耗3molCO2,转移12mol电子
D. 充电时的阳极反应为C+2Na2CO3-4e-=3CO2↑+4Na+
查看答案和解析>>
科目:高中化学 来源: 题型:
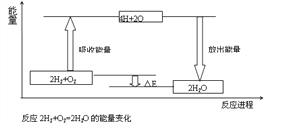
【题目】试从化学键的角度理解化学反应中的能量变化。(以2H2+O2===2H2O为例说明),已知:E反表示反应物(2H2+O2)所具有的总能量,E生表示生成物(2H2O)所具有的总能量。又知:拆开1moL H2中的化学键需要吸收436kJ能量,拆开1moL O2中的化学键需要吸收496kJ能量,形成水分子中的1moLH—O键能够释放463KJ能量。
⑴从宏观角度看:反应物所具有的总能量高于生成物所具有的总能量,所以该反应要______(填“吸收”或“放出”)能量,能量变化值的大小△E=_________(用E反和E生表示)
⑵从微观角度看:断裂反应物中的化学键吸收的总能量为E吸=______KJ;形成生成物中的化学键放出的总能量为=______KJ。E吸______E放(填“>”或“<”),所以该反应要_____(填“吸收”或“放出”)能量,能量变化值的大小△E=____ KJ(填数值)
⑶由图可知,化学反应的本质是________________________________化学反应中能量变化的主要原因是________________(从总能量说明)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com