
【题目】下列各组离子在强碱性溶液中一定能大量共存的是( )
A. Na+、NH4+、SO42-B. Ag+、Fe3+、Cl-
C. Ba2+、K+、NO3-D. K+、Ba2+、HCO3-
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】某校化学研究性学习小组的同学在学习了氨的性质讨论:运用类比的思想,既然氨气具有还原性,能否像H2那样还原CuO呢?他们设计实验制取氨气并探究上述问题。请你参与该小组的活动并完成下列研究:
(一)制取氨气
(1)写出实验室制取氨气的化学方程式______________________;
(2)在实验室中,还可以用浓氨水与______(填写一种试剂)快速制取少量氨气;
(3)有同学模仿排饱和食盐水收集氯气的方法,想用排饱和氯化铵溶液的方法收集氨气。你认为能否达到目的?_______(填“能”或“否”),理由是_____________________ 。
(4)检验铵盐中的阳离子时,取少量铵盐于试管中,____________则证明铵盐中有该NH4+离子。反应的离子方程式______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质均属于分子晶体且均为化合物的是( )
A.NH3、HD、C10H8B.PCl3、CO2、AlCl3
C.SO2、SiO2、P2O5D.CCl4、H2O2、Na2S
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,下列溶液的离子浓度关系式正确的是( )
A.pH=5的H2S溶液中,c(H+)=c(HS﹣)=1×10﹣5molL﹣1
B.pH=a的氨水溶液,稀释10倍后,其pH=b,则a=b+1
C.pH=2的H2C2O4溶液与pH=12的NaOH溶液任意比例混合:c(Na+)+c(H+)=c(OH﹣)+c(HC2O4﹣)
D.pH相同的①CH3COONa②NaHCO3③NaClO三种溶液的c(Na+):①>②>③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:①Cl2+2KBr====2KCl+Br2,②KClO3+6HCl(浓)====3Cl2↑+KCl+3H2O,③2KBrO3+Cl2====Br2+2KClO3,下列说法正确的是 ( )
A. 上述3个反应都是置换反应
B. 氧化性由强到弱的顺序为KBrO3>KClO3>Cl2>Br2
C. 反应②中若得到6.72 L Cl2(标准状况),则电子转移个数为3.01×1023
D. ③中1 mol氧化剂参加反应得到电子的物质的量为2 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为反应2X(g)+Y(s)2Z(g)的反应过程和能量关系图,下列说法正确的是( ) 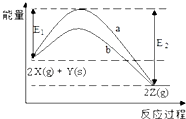
A.曲线a和b表示两个反应过程的反应热不同
B.曲线a一定表示反应是在无催化剂时的反应过程
C.增大压强,X的转化率一定增大
D.反应达平衡,升高温度,平衡常数K值一定减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.乙酸是一种弱酸,不能和碳酸钙反应放出二氧化碳气体
B.润滑油属于酯类
C.没有成熟的苹果汁遇碘变蓝色,成熟的苹果汁能还原新制氢氧化铜悬浊液
D.糖类、油脂、蛋白质都是由C,H,O三种元素组成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业.某学生在实验室利用如图的实验装置制备乙酸乙酯并研究其反应条件. 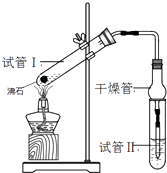
物质 | 沸点/°C | 密度/gcm﹣3 |
乙醇 | 78.0 | 0.79 |
乙酸 | 117.9 | 1.05 |
乙酸乙酯 | 77.5 | 0.90 |
异戊醇 | 131 | 0.8123 |
乙酸异戊酯 | 142 | 0.8670 |
实验步骤如下:
①配制反应混合液:2mL浓H2SO4、3mL乙醇、2mL乙酸
②按图连接实验装置并检验气密性
③分别在试管1、试管2中加入反应液
④用酒精灯微热3min,再加热使之微微沸腾3min
⑤分离提纯乙酸乙酯
(1)在试管1中加入物质分别是:(按着加入的先后顺序写出名称),乙醇过量的目的是:;
(2)该反应的平衡常数表达式K=;
(3)试管Ⅱ中所盛试剂为 , 欲将其物质分离使用的仪器为 , 在充分振荡的过程中,发生的反应为;
(4)为证明浓硫酸在该反应中起到了催化剂和吸水剂的作用,某同学利用右图所示装置进行了以下四个实验,实验结束后充分振荡试管Ⅱ再测有机层的厚度,实验记录如下:
实验编号 | 试管Ⅰ中的试剂 | 测得有机层的厚度/cm |
A | 2mL乙醇、2mL乙酸、1mL 18mol/L浓硫酸 | 5.0 |
B | 3mL乙醇、2mL乙酸 | 0.1 |
C | 3mL乙醇、2mL乙酸、6mL 3mol/L硫酸 | 1.2 |
D | 3mL乙醇、2mL乙酸、盐酸 | 1.2 |
①实验D的目的是与实验C相对照,证明H+对酯化反应具有催化作用.实验D中应加入盐酸的体积和浓度分别是mL和mol/L;
②分析实验(填实验编号)的数据,可以推测出浓硫酸的吸水性提高了乙酸乙酯的产率.浓硫酸的吸水性能够提高乙酸乙酯产率的原因是
③加热有利于提高乙酸乙酯的产率,但实验发现温度过高乙酸乙酯的产率反而降低,可能的原因是;
(5)若利用该装置制备乙酸异戊酯,产物将主要在装置中的得到,那么产率会(“较高”或“偏低”).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com