
【题目】某校化学研究性学习小组的同学在学习了氨的性质讨论:运用类比的思想,既然氨气具有还原性,能否像H2那样还原CuO呢?他们设计实验制取氨气并探究上述问题。请你参与该小组的活动并完成下列研究:
(一)制取氨气
(1)写出实验室制取氨气的化学方程式______________________;
(2)在实验室中,还可以用浓氨水与______(填写一种试剂)快速制取少量氨气;
(3)有同学模仿排饱和食盐水收集氯气的方法,想用排饱和氯化铵溶液的方法收集氨气。你认为能否达到目的?_______(填“能”或“否”),理由是_____________________ 。
(4)检验铵盐中的阳离子时,取少量铵盐于试管中,____________则证明铵盐中有该NH4+离子。反应的离子方程式______________________。
【答案】 Ca(OH)2+2NH4Cl![]() CaCl2+2NH3↑+2H2O CaO(或NaOH固体或碱石灰均可) 否 NH3极易溶于水 加入NaOH溶液,加热,有使湿润的红色石蕊试纸变蓝的气体生成 NH4++OH-
CaCl2+2NH3↑+2H2O CaO(或NaOH固体或碱石灰均可) 否 NH3极易溶于水 加入NaOH溶液,加热,有使湿润的红色石蕊试纸变蓝的气体生成 NH4++OH-![]() NH3↑+H2O
NH3↑+H2O
【解析】(1)实验室利用氯化铵与消石灰在加热的条件下制取氨气,反应的化学方程式为Ca(OH)2+2NH4Cl![]() CaCl2+2NH3↑+2H2O;(2)浓氨水中存在:NH3+H2O
CaCl2+2NH3↑+2H2O;(2)浓氨水中存在:NH3+H2O![]() NH3·H2O
NH3·H2O![]() NH4++OH-,加入固态碱性物质(如CaO、NaOH、碱石灰等),使反应逆向移动,同时反应放热,促进NH3·H2O的分解,从而可以快速的制备少量氨气。(3)由于NH3极易溶于水,所以不能用排饱和氯化铵溶液的方法收集氨气。(4)铵盐能与强碱反应放出碱性气体氨气,则检验铵盐中的阳离子时,可以取少量铵盐于试管中,加入NaOH溶液,加热,有使湿润的红色石蕊试纸变蓝的气体生成,则证明铵盐中有NH4+离子,反应的离子方程式为NH4++OH-
NH4++OH-,加入固态碱性物质(如CaO、NaOH、碱石灰等),使反应逆向移动,同时反应放热,促进NH3·H2O的分解,从而可以快速的制备少量氨气。(3)由于NH3极易溶于水,所以不能用排饱和氯化铵溶液的方法收集氨气。(4)铵盐能与强碱反应放出碱性气体氨气,则检验铵盐中的阳离子时,可以取少量铵盐于试管中,加入NaOH溶液,加热,有使湿润的红色石蕊试纸变蓝的气体生成,则证明铵盐中有NH4+离子,反应的离子方程式为NH4++OH-![]() NH3↑+H2O。
NH3↑+H2O。


科目:高中化学 来源: 题型:
【题目】如图,利用培养皿探究SO2的性质,实验时向Na2SO3固体上滴几滴浓硫酸,立即用另一表面扣在上面。表中对实验现象的描述或解释不正确的是
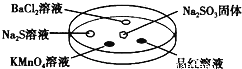
选项 | 实验现象 | 解释 |
A | BaCl2溶液变浑浊 | SO2与BaCl2溶液反应产生了BaSO3沉淀 |
B | Na2S溶液变浑浊 | SO2与Na2S溶液反应产生了S单质 |
C | 酸性KMnO4溶液褪色 | SO2具有还原性 |
D | 品红溶液褪色 | SO2具有漂白性 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备氯气(Cl2)的化学方程式如下:
4HCl(浓) + MnO2 ![]() MnCl2 + Cl2↑ +2 H2O
MnCl2 + Cl2↑ +2 H2O
(1)用单线桥表示出电子转移的方向和数目________________________,
(2)将题干中反应改写成离子方程式是___________________________。
(3)在上述过程中,被氧化的元素是_________,还原产物是___________,氧化剂和还原剂的物质的量之比为:__________;该反应中盐酸体现的性质为:__________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将足量CO2通入KOH和Ca(OH)2的混合稀溶液100mL中,生成沉淀的质量(m)与通入(STP)状况下CO2的体积(V)之间关系如图所示:
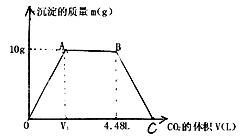
(1)写同下列各段发生的离子方程式
①OA_____________________ ;
②AB_____________________;
③BC_____________________;
(2)C点对应溶液中溶质离子有:_____________________;
(3)V1=_________________L;
(4)KOH物质的量浓度c=____________________mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于食物中的基本营养物质的叙述不正确的是
A. 蔗糖和麦芽糖互为同分异构体
B. 葡萄糖在碱性、加热条件下可以与银氨溶液反应
C. 植物油和动物脂肪中碳原子的连接方式完全相同
D. 酶是生物体内重要的催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丁香油酚的结构简式为  据此结构分析,下列说法正确的是( )
据此结构分析,下列说法正确的是( )
A.可以燃烧,只能与溴水发生加成反应
B.可与NaOH溶液反应,也可与FeCl3溶液反应
C.不能与金属钠反应放出H2
D.可以与小苏打溶液反应放出CO2气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空
(1)水被称为“生命之源”,为了给某地区的人民寻找合适的饮用水源,某化学小组对附近山上的泉水进行了分析,结果显示水体硬度超标,其水体中主要含Ca2+、Mg2+、HCO3﹣和Cl﹣ . 则该水源属于(填“暂时”或“永久”)硬水,可通过加热煮沸来降低水体的硬度,水体中的Ca2+、Mg2+在加热煮沸后将分别转化为、形成水垢.
(2)我国化工专家侯德榜,改进氨碱法设计了“联合制碱法”,为世界制碱工业作出了突出贡献.生产流程如图: 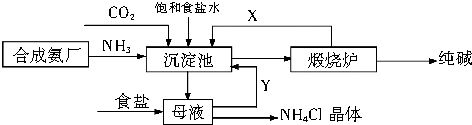
①向沉淀池中通入NH3和CO2气体时,正确的顺序是 .
②流程图中X表示的物质是
(3)贵州铝厂是目前我国最大的电解铝生产基地.所需生产原料Al2O3可以从铝土矿(主要成分是Al2O3 , 含SiO2、Fe2O3、MgO等杂质)中提取,其工艺流程如下: 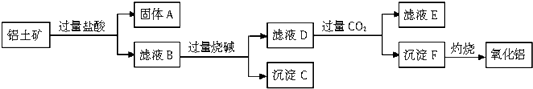
请回答下列问题:
①固体A是 , 滤液E中含有的溶质是
②已知298K时,Mg(OH)2的容度积常数Ksp=5.6×10﹣12 , 取适量的滤液B,加入一定量的烧碱达到沉淀溶解平衡时,测得pH=13.0,则此时溶液中的c(Mg2+)=molL﹣1 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子在强碱性溶液中一定能大量共存的是( )
A. Na+、NH4+、SO42-B. Ag+、Fe3+、Cl-
C. Ba2+、K+、NO3-D. K+、Ba2+、HCO3-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com