
����Ŀ��������������Ҫ���л��ϳ��м��壬�㷺Ӧ���ڻ�ѧ��ҵ��ijѧ����ʵ����������ͼ��ʵ��װ���Ʊ������������о��䷴Ӧ������ 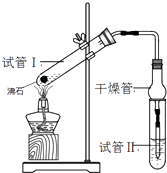
���� | �е�/��C | �ܶ�/gcm��3 |
�Ҵ� | 78.0 | 0.79 |
���� | 117.9 | 1.05 |
�������� | 77.5 | 0.90 |
���촼 | 131 | 0.8123 |
���������� | 142 | 0.8670 |
ʵ�鲽�����£�
�����Ʒ�Ӧ���Һ��2mLŨH2SO4��3mL�Ҵ���2mL����
�ڰ�ͼ����ʵ��װ�ò�����������
�۷ֱ����Թ�1���Թ�2�м��뷴ӦҺ
���þƾ�����3min���ټ���ʹ֮����3min
�ݷ����ᴿ��������
��1�����Թ�1�м������ʷֱ��ǣ������ż�����Ⱥ�˳��д�����ƣ����Ҵ�������Ŀ���ǣ���
��2���÷�Ӧ��ƽ�ⳣ������ʽK=��
��3���Թܢ�����ʢ�Լ�Ϊ �� ���������ʷ���ʹ�õ�����Ϊ �� �ڳ���Ĺ����У������ķ�ӦΪ��
��4��Ϊ֤��Ũ�����ڸ÷�Ӧ�����˴�������ˮ�������ã�ijͬѧ������ͼ��ʾװ�ý����������ĸ�ʵ�飬ʵ������������Թܢ��ٲ��л���ĺ�ȣ�ʵ���¼���£�
ʵ���� | �Թܢ��е��Լ� | ����л���ĺ��/cm |
A | 2mL�Ҵ���2mL���ᡢ1mL 18mol/LŨ���� | 5.0 |
B | 3mL�Ҵ���2mL���� | 0.1 |
C | 3mL�Ҵ���2mL���ᡢ6mL 3mol/L���� | 1.2 |
D | 3mL�Ҵ���2mL���ᡢ���� | 1.2 |
��ʵ��D��Ŀ������ʵ��C����գ�֤��H+��������Ӧ���д����ã�ʵ��D��Ӧ��������������Ũ�ȷֱ���mL��mol/L��
�ڷ���ʵ������ʵ���ţ������ݣ������Ʋ��Ũ�������ˮ����������������IJ��ʣ�Ũ�������ˮ���ܹ���������������ʵ�ԭ����
�ۼ���������������������IJ��ʣ���ʵ�鷢���¶ȹ������������IJ��ʷ������ͣ����ܵ�ԭ������
��5�������ø�װ���Ʊ����������������ォ��Ҫ��װ���еĵõ�����ô���ʻ������ϸߡ���ƫ�͡�����
���𰸡�
��1�����Ƭ����������ת����
��2��![]()
��3������̼������Һ����Һ©����2CH3COOH+Na2CO3�T2CH3COONa+CO2��+H2O
��4��6��6��A��C��Ũ�����������������Ӧ�����ɵ�ˮ��������������Ũ��ʹƽ�����������������ķ����ƶ����������ᡢ�Ҵ�δ����Ӧ�����뷴Ӧ��ϵ���¶ȹ��߷���������Ӧ
��5����
���������⣺��1�����ᡢ�Ҵ���Ũ���������������·�����Ӧ��������������Ũ����ϡ�Ͳ����������ȣ��ܶȴ���ˮ��Ϊ��ֹ��Һ�ɽ���Ӧ�ȼ����Ҵ���Ȼ���ڼ���Ũ��������ᣬ�����Թ�1������˳�����ȼ����Ҵ����ټ���Ũ���ᣬ���������ᣬ����Ũ���ᡢ�Ҵ���������Һ�����������У�Ϊ��ֹ��������Ӧ���룺���Ƭ��Ũ�����ܶȴ�Ӧ��Ũ������뵽�Ҵ��У��Է���Һ�ɽ��������ӷ�����ȴ���ټ����������˳������3mL�Ҵ���2mLŨH2SO4��2mL������淴Ӧ�У�����һ�ַ�Ӧ���Ũ�ȿ��������һ�ַ�Ӧ���ת���ʣ������Ҵ�������Ŀ���ǣ���������ת���ʣ�
���Դ��ǣ��Ҵ���Ũ���ᡢ���ᡢ���Ƭ��3mL�Ҵ���2mLŨH2SO4��2mL�����������ת���ʣ�
��2.�����ݷ���ʽ��CH3COOH��g��+CH3CH2OH��g�� ![]() CH3COOCH2CH3��g��+H2O��g������֪��Ӧ��ƽ�ⳣ��K=
CH3COOCH2CH3��g��+H2O��g������֪��Ӧ��ƽ�ⳣ��K= ![]() ��
��
���Դ��ǣ� ![]() ��
��
��3.���Ҵ��������ӷ����Ʊ������������к����Ҵ������ᣬ�Ҵ�������ˮ�������ܹ���̼������Һ��Ӧ������ʽ��2CH3COOH+Na2CO3�T2CH3COONa+CO2��+H2O�����������ڱ���̼������Һ���ܽ�Ȳ������Կ����ñ���̼������Һ��ȥ�Ҵ������ᣬ���������������ܽ�ȣ��������ֻ������ܵ�Һ��Ӧѡ���Һ�������õ�����Ҫ����Ϊ����Һ©����
���Դ��ǣ�����̼������Һ��2CH3COOH+Na2CO3�T2CH3COONa+CO2��+H2O����Һ©��
��4.����ͨ������ʵ�飬֤��H+��������Ӧ���д����ã�Ӧ��֤������Ũ����������ʵ�����ȣ���HCl��Ũ��Ϊ3mol/L��2=6mol/L���������Ϊ6mL��
���Դ��ǣ�6��6���ڴ���ΪŨ���������л����ȱ�3molL��1 H2SO4ʱ�����л����Ⱥ�˵��Ũ����Ũ�������ˮ���ܹ���������������ʣ�ԭ���ǣ�Ũ�����������������Ӧ�����ɵ�ˮ��������������Ũ��ʹƽ�����������������ķ����ƶ���
���Դ��ǣ�AC��Ũ�����������������Ӧ�����ɵ�ˮ��������������Ũ��ʹƽ�����������������ķ����ƶ��������ᡢ�Ҵ��ӷ����¶ȹ��ߴ������ᡢ�Ҵ�δ����Ӧ�����뷴Ӧ��ϵ�����¶ȹ��߷���������Ӧ�����²��ʽ��ͣ����Դ��ǣ��������ᡢ�Ҵ�δ����Ӧ�����뷴Ӧ��ϵ���¶ȹ��߷���������Ӧ��
��5.�������������е�142�ȣ���������������������Ҫ���Թ��еõ������ﲻ�ܷ��룬������Ũ������ƽ�������ƶ������Ʒ�Ӧ���У����Բ��ʻ�ͣ�
���Դ��ǣ��Թܣ��ͣ�


 ��ְٷְټ�����Ԫ��ĩ���Ծ�ϵ�д�
��ְٷְټ�����Ԫ��ĩ���Ծ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и���������ǿ������Һ��һ���ܴ���������ǣ� ��
A. Na+��NH4+��SO42-B. Ag+��Fe3+��Cl-
C. Ba2+��K+��NO3-D. K+��Ba2+��HCO3-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й��������ʵıȽϣ��������( )
A.�ܽ��(25��)��С�մ� < �մ�B.�е㣺H2Se>H2S>H2O
C.�ܶȣ������� > ˮD.̼̼����������ϩ < ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����³����Լ���������ǣ� ��
ѡ�� | ���� | ���� | �����Լ� | ��Ӧ��������ӷ��� |
A | �� | ���� | �ռ���Һ | ��Һ |
B | �� | �� | ϡ���� | ���� |
C | ���� | �Ȼ��� | ����ʳ��ˮ | ϴ�� |
D | ���� | ��ϩ | ���� | ���������� |
A.A
B.B
C.C
D.D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�����λ�ѧʽΪNa2FeO4�����н�ǿ��ɱ���������ܣ���һ����ɫ������Ⱦ�ľ�ˮ����������Ԫ�صĻ��ϼ���
A. +2B. +3C. +4D. +6
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ��̽��ľ̿��ŨH2SO4��Ӧ�IJ������Ƿ����CO2��ijͬѧѡ����ͼ��ʾװ�ý���ʵ��:
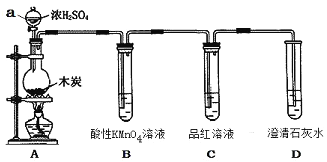
��1������a������Ϊ:___________������װ������ʵ��װ�ú���װ��ҩƷ֮ǰ�����ʵ�������___________��
��2��д��A�з�����Ӧ�Ļ�ѧ����ʽ_______________��
��3��װ��B��������_______����װ���з����Ļ�ѧ��Ӧ��˵��SO2����_______________�ԡ�
��4����֪SO2Ҳ����ʹ�����ʯ��ˮ����ǣ�����˵��������һ������CO2�����ʵ������Ϊ______________��____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ������������������Ʊ��������������й����ʵ�����������±���
������ | ��Է� | �ܶ� | �е�/�� | �ܽ�� |
������ | 74 | 0.80 | 118.0 | 9 |
������ | 60 | 1.045 | 118.1 | ���� |
���������� | 116 | 0.882 | 126.1 | 0.7 |
�������£�
����50mLԲ����ƿ�У�����18.5mL��������13.4mL�����ᣬ3��4��Ũ���ᣬͶ���ʯ����װ��ˮ�������ã�ʵ������в��Ϸ����ȥ��Ӧ���ɵ�ˮ�������������ܣ�
�ڽ���ˮ���ֳ�������ͷ�ӦҺһ�����Һ©���У�ˮϴ��10% Na2CO3ϴ�ӣ���ˮϴ�����ת������ƿ�����
�۽�����������������������ƿ�У���ѹ�����ռ���֣���15.1g������������
��ش��й����⣺
��1����ˮӦ�ô����������a����b�����˹ܿ�ͨ�룮
��2�����з�Һ����ʱ��ʹ�õ�©��������ѡ���
��3������A��������������Ʊ������������Ļ�ѧ����Ϊ ��
��4������١����Ϸ����ȥ��Ӧ���ɵ�ˮ����Ŀ���� ��
��5�����������10% Na2CO3��Һϴ���л��㣬�ò�������Ŀ����
��6�������������IJ���Ϊ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����( )
���е��ʲμӻ����ɵķ�Ӧһ����������ԭ��Ӧ
����Al2(SO4)3��Һ����εμ�Ba(OH)2��Һ�������ɰ�ɫ�������������ʧ
������BaCl2��NaOH�Ļ����Һ��ͨ�������Ķ����������壬�а�ɫ��������
����CaCl2��Һ��ͨ������������̼���壬�����ɰ�ɫ�������������ʧ
��101kPa��150��ʱ��agCO��H2�Ļ��������������O2����ȫȼ�գ���ȼ�պ�IJ���ͨ��������Na2O2�����Na2O2����ag
��Ϊ�ⶨ�����������Ƶĵ����ԣ����ڸ���(��Ҫ�ɷ���Al2O3) �������ۻ��������ƹ������в���
����������һ���ǽ���������
��22.4L��CO�����28gN2�����ĵ��������
A. �٢ڢܢޢ� B. �ۢܢ� C. �٢ݢޢ� D. �ۢݢ�
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com