
【题目】下列框图所示的物质转化关系中,甲是日常生活中常见的金属,乙、丙、丁是常见的气体单质。气体B 与气体C 相遇产生大量的白烟,D 是海水中浓度最高的盐(部分反应物和生成物及溶剂水已略去)。

请回答下列问题:
(1) B、E 的电子式为______________________、__________________。
(2)工业上常用电解饱和 D 溶液来制备丁,请写出此反应的化学方程式:_______;阴极产物为___________________________。
(3)A 和 E 加热条件下反应的化学方程式______________________________。
(4)乙和丙反应的化学方程式______________________________________。
(5)B 和氧气在催化剂作用能发生反应,写出其化学反应方程式:_____。
(6)固态的 A 和 C 晶体类型分别属于_________、__________;固态的 A 熔融时需要克服的微粒间作用力为___________,将C 溶于水需要克服的作用力为___________________。
【答案】![]()
 2NaCl+2H2O
2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑ H2、NaOH NaOH+NH4Cl
2NaOH+H2↑+Cl2↑ H2、NaOH NaOH+NH4Cl![]() NaCl+H2O+NH3↑ N2+3H2
NaCl+H2O+NH3↑ N2+3H2![]() 2NH3 4NH3+5O2
2NH3 4NH3+5O2 4NO+6H2O 离子晶体 分子晶体; 离子键 共价键
4NO+6H2O 离子晶体 分子晶体; 离子键 共价键
【解析】
乙、丙为单质,在高温高压下催化生成B,且B与C相遇生成大量白烟,可知B为NH3,C为HCl,则丙为H2,乙为N2,丁为气体单质,应为Cl2,E为NH4Cl,可与A反应生成NH3,D是海水中浓度最高的盐,应为NaCl,说明A应为NaOH,则甲为Al,结合对应物质的性质以及题目要求可解答该题。
由分析知:甲为Al、乙为N2、丙为H2、丁为Cl2,A为NaOH、B为NH3、C为HCl、D为NaCl、E为NH4Cl;则
(1)B为NH3,是共价化合物,其电子式为![]() ;E为NH4Cl,是离子化合物,其电子式为
;E为NH4Cl,是离子化合物,其电子式为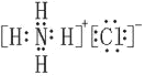 ;
;
(2)工业上常用电解饱和 NaCl溶液来制备Cl2,发生反应的化学方程式为2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑;阴极上发生电极反应为2H2O-2e-=H2↑+2OH-,则产物为H2、NaOH;
2NaOH+H2↑+Cl2↑;阴极上发生电极反应为2H2O-2e-=H2↑+2OH-,则产物为H2、NaOH;
(3)NaOH溶液和 NH4Cl溶液混合加热生成氨气,发生反应的化学方程式为NaOH+NH4Cl![]() NaCl+H2O+NH3↑;
NaCl+H2O+NH3↑;
(4)N2和H2在高温、高压、催化作用下生成氨气,发生反应的化学方程式为N2+3H2![]() 2NH3;
2NH3;
(5)NH3和氧气在催化剂作用下生成NO和水,发生化学反应方程式为4NH3+5O2 4NO+6H2O;
4NO+6H2O;
(6)固态的 NaOH为离子晶体,熔化时需要克服的微粒间作用力为离子键; 固态HCl晶体类型为分子晶体,将HCl溶于水需要克服的作用力为极性共价键。


科目:高中化学 来源: 题型:
【题目】金属及其相关化合物在化工、医药、材料等领域有着广泛的应用。回答下列问题:
(1)下列关于金属及金属键的说法不正确的是______。(填字母代号)
a.金属键没有方向性与饱和性
b.金属键是金属原子与自由电子间的相互作用
c.金属熔沸点不同的原因可以用金属键强弱解释
d.电子气理论可解释金属材料的延展性,不能解释金属有良好的导电性
(2)钒广泛用于催化及钢铁工业,基态钒原子的价层电子排布图为_________________。
(3)二茂铁又叫双环戊二烯基铁[Fe(C5H5)2],熔点是172.5~173 ℃,100 ℃以上升华,二茂铁属于_____晶体。已知分子中的大π键可用符号![]() 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为![]() )。已知二茂铁的每个茂环带有一个单位负电荷,则每个环中的大π键应表示为________________。
)。已知二茂铁的每个茂环带有一个单位负电荷,则每个环中的大π键应表示为________________。
(4)铜可以形成一种离子化合物[Cu(NH3)4(H2O)2]SO4,若要确定[Cu(NH3)4(H2O)2]SO4是晶体还是非晶体,最科学的方法是对其进行______实验,其中阴离子的空间构型是_____,该化合物加热时首先失去的组分是H2O,原因是_______________________。
(5)最近发现,只含镁、镍和碳三种元素的晶体也具有超导性,该物质形成的晶体的立方晶胞结构如图所示。
①与Mg紧邻的Ni有________个。
②原子坐标参数可表示晶胞内部各原子的相对位置。该晶胞中原子的坐标参数为a为(0,0,0);b为(1/2,1/2,0);d为(1,1,1)。则c原子的坐标参数为_______。
③若晶胞中Ni、Mg之间的最短距离为a pm,阿伏加德罗常数的值为NA,则晶体的密度ρ=______g·cm-3(用含a、NA的代数式表示)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2是一种高效、广谱、安全的杀菌、消毒剂,易溶于水。制备方法如下:
(1)步骤Ⅰ:电解食盐水制备氯酸钠。用于电解的食盐水需先除去其中的 Ca2+、Mg2+、SO42-等杂质。在除杂操作时,往粗盐水中先加入过量的________(填化学式),至沉淀不再产生后,再加入过量的________和NaOH,充分反应后将沉淀一并滤去。
(2)步骤Ⅱ:将步骤Ⅰ得到的食盐水在特定条件下电解得到氯酸钠(NaClO3),再将它与盐酸反应生成ClO2与Cl2,ClO2与Cl2的物质的量比是____________。
(3)学生拟用左下图所示装置模拟工业制取并收集ClO2,用NaClO3和草酸(H2C2O4)恒温在60℃ 时反应制得。

反应过程中需要对A容器进行加热,加热的方式为____________;加热需要的玻璃仪器除酒精灯外,还有_________________;
(4)反应后在装置C中可得亚氯酸钠(NaClO2)溶液。已知NaClO2饱和溶液在温度低于38℃时,析出的晶体是NaClO2·3H2O,在温度高于38℃时析出的是NaClO2。根据右上图所示NaClO2的溶解度曲线,请完成从NaClO2溶液中制得NaClO2·3H2O的操作步骤:
①_____________;②_______________;③洗涤;④干燥。
(5)目前我国已成功研制出利用NaClO2制取二氧化氯的新方法,将Cl2通入到NaClO2溶液中。现制取270kg二氧化氯,需要亚氯酸钠的质量是________。
(6)ClO2和Cl2均能将电镀废水中的剧毒CN-氧化为无毒物质,自身被还原为Cl-。处理含CN-相同量的电镀废水,所需Cl2的物质的量是ClO2的_______倍。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用电解法无害化处理水体中的NO3-,最终生成N2逸出。其装置及转化如图所示。列说法正确的是

A.N电极为电源的负极
B.电解池工作时Na+移向电极Ⅱ
C.电极Ⅰ的电极反应:NO3-+8e+10H+=NH4++3H2O
D.电解池工作时电极Ⅰ产生的NH4+被电极Ⅱ产生的HClO氧化为N2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用绿矾(FeSO4·7H2O)制备补血剂甘氨酸亚铁[(H2NCH2COO)2Fe],有关物质性质如下:
甘氨酸(H2NCH2COOH) | 柠檬酸 | 甘氨酸亚铁 |
易溶于水,微溶于乙醇,两性化合物 | 易溶于水和乙醇,有酸性和还原性 | 易溶于水,难溶于乙醇 |
实验过程:
I.配制含 0.10molFeSO4 的绿矾溶液。
II.制备 FeCO3: 向配制好的绿矾溶液中,缓慢加入 200mL1.1mol/LNH4HCO3 溶液,边加边搅拌,反应结束后过滤并洗涤沉淀。
III.制备(H2NCH2COO)2Fe: 实验装置如下图(夹持和加热仪器已省略),将实验 II 得到的沉淀和含 0.20mol 甘氨酸的水溶液混合后加入 C 中,然后利用 A 中反应产生的气体将 C 中空气排净,接着滴入柠檬酸溶液并加热。反应结束后过滤,滤液经蒸发结晶、过滤、洗涤、干燥得到产品。

回答下列问题:
(1)实验 I 中:配制绿矾溶液时,为防止 FeSO4 被氧化变质,应加入试剂为_________ (写化学式)。
(2)实验 II 中:生成沉淀的离子方程式为_______________________________________。
(3)实验 III 中:
①装置 A中所盛放的药品是_______ (填序号)。
a.Na2CO3 和稀 H2SO4 b.CaCO3 和稀 H2SO4 c.CaCO3 和稀盐酸
②确认 C 中空气排尽的实验现象是___________________________________________。
③加入柠檬酸溶液一方面可调节溶液的 pH 促进 FeCO3 溶解,另一个作用是________。
④洗涤实验 III 中得到的沉淀,所选用的最佳洗涤试剂是__________ (填序号)。
a.热水 b.乙醇溶液 c.柠檬酸溶液
⑤若产品的质量为 17.34g,则产率为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是( )
A. 用银氨溶液检验乙醛中的醛基:CH3CHO + 2Ag(NH3)2+ +2OH-![]() CH3COONH4 + 3NH3 + 2Ag↓+ H2O
CH3COONH4 + 3NH3 + 2Ag↓+ H2O
B. 苯酚钠溶液中通入少量CO2:CO2+ H2O + 2C6H5O-→ 2C6H5OH + CO32-
C. 氯乙烷中滴入AgNO3溶液检验其中氯元素:Cl-+ Ag+ =AgCl↓
D. 硫酸铝溶液中加入过量的氨水:Al3+ + 3NH3·H2O=Al(OH)3↓ + 3NH4+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列说法正确的是
A. 电解精炼铜,当外电路通过NA个电子时;阳极质量减少32 g
B. 反应3H2(g)+N2(g) ![]() 2NH3(g) △H=-92kJ·mol-1,当放出热量 9.2 kJ时,转移电子0.6 NA
2NH3(g) △H=-92kJ·mol-1,当放出热量 9.2 kJ时,转移电子0.6 NA
C. lmol·L-1的氯化铜溶液中,若Cl-的数目为2Na,则Cu2+的数目为Na
D. 标准状况下,NO和O2各11. 2L混合充分反应,所得气体的分子总数为0.75 Na
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1, 2-二溴乙烷的制备原理是CH3CH2OH![]() CH2=CH2↑+H2O;CH2=CH2+Br2→BrCH2—CH2Br。某课题小组用下图所示的装置制备1, 2-二溴乙烷。
CH2=CH2↑+H2O;CH2=CH2+Br2→BrCH2—CH2Br。某课题小组用下图所示的装置制备1, 2-二溴乙烷。
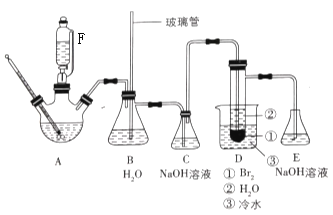
回答下列问题:
(1)组装仪器后进行该实验前必须进行的操作是___________。
(2)装置B的作用是____________。
(3)三颈瓶内加入一定量的乙醇-浓硫酸混合液和少量粗砂,加入粗砂的目的是_____,仪器F的名称是________。
(4)装置C内发生的主要反应的离子方程式为_________。
(5)加热三颈烧瓶前,先将C与D连接处断开,再将三颈烧瓶在石棉网上加热,待温度升到约120℃时,连接C与D,并迅速将A反应温度升温至160~180℃,从F中慢慢滴加乙醇-浓硫酸混合液,保持乙烯气体均匀地通入装有3.20mL液溴![]() 和3mL水的D中试管,直至反应结束。
和3mL水的D中试管,直至反应结束。
①将C与D连接处断开的原因是_____________________。
②判断反应结束的现象是____________________
(6)将粗品移入分液漏斗,分别用a. 水洗涤,b. 氢氧化钠溶液洗涤,c. 过滤,d. 用无水氯化钙干燥,e. 蒸馏收集129~133℃馏分,最后得到7.896g 1, 2-二溴乙烷。
①粗品提纯的步骤是______(填序号),②1, 2-二溴乙烷的产率为________。
(7)下列操作中,不会导致产物产率降低的是______(填正确答案的标号)
a. 乙烯通过溴水时速率太快 b. 装置C中的NaOH溶液用水代替
c. 去掉装置D烧杯中的水 d.实验时没有E装置 e. D中的试管里不加水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、M、X、Y、Z是周期表前36号元素中的四种常见元素,其原子序数依次增大。W的一种核素在考古时常用来鉴定一些文物的年代;M的氧化物是导致酸雨的主要物质之一。X的某一种单质在高空大气层中保护人类免遭太阳光中紫外线的强烈侵袭;Y的基态原子核外有6个原子轨道处于半充满状态;Z能形成红色的Z2O和黑色的ZO两种氧化物。
(1)Y3+基态电子排布式可表示为________。
(2)MX3-的空间构型是________(用文字描述)。H2X分子的VSEPR模型名称为________。
(3)含Z(H2X)42+的溶液中通入MH3,会生成Z(MH3)42+的原因___________________________。(从电负性角度解释)
(4) 1 mol WX2中含有的π键数目为________。
(5) AlP因杀虫效率高、廉价易得而被广泛应用。已知AlP的熔点为2000℃ ,其晶胞结构如图所示。
①磷化铝的晶体类型为_____________。
②A、B点的原子坐标如图所示,则C点的原子坐标为_______。
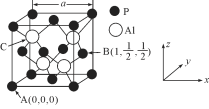
③磷化铝的晶胞参数a=546.35pm(1pm=10-12m),其密度为____________ g/cm3(列出计算式即可,用NA表示阿伏加德罗常数的数值)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com