
【题目】W、M、X、Y、Z是周期表前36号元素中的四种常见元素,其原子序数依次增大。W的一种核素在考古时常用来鉴定一些文物的年代;M的氧化物是导致酸雨的主要物质之一。X的某一种单质在高空大气层中保护人类免遭太阳光中紫外线的强烈侵袭;Y的基态原子核外有6个原子轨道处于半充满状态;Z能形成红色的Z2O和黑色的ZO两种氧化物。
(1)Y3+基态电子排布式可表示为________。
(2)MX3-的空间构型是________(用文字描述)。H2X分子的VSEPR模型名称为________。
(3)含Z(H2X)42+的溶液中通入MH3,会生成Z(MH3)42+的原因___________________________。(从电负性角度解释)
(4) 1 mol WX2中含有的π键数目为________。
(5) AlP因杀虫效率高、廉价易得而被广泛应用。已知AlP的熔点为2000℃ ,其晶胞结构如图所示。
①磷化铝的晶体类型为_____________。
②A、B点的原子坐标如图所示,则C点的原子坐标为_______。
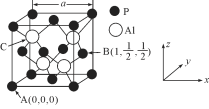
③磷化铝的晶胞参数a=546.35pm(1pm=10-12m),其密度为____________ g/cm3(列出计算式即可,用NA表示阿伏加德罗常数的数值)。
【答案】1s22s22p63s23p63d3或[Ar]3d3 平面正三角形 四面体形 H2O中O的电负性大,不易提供孤电子对形成配位键 2NA 原子晶体 (1/4,1/4,3/4) ![]()
【解析】
用来鉴定文物年代的是14C,所以W为碳元素;能在高空大气层中保护人类免遭太阳光中紫外线的强烈侵袭的单质是臭氧,所以X是氧元素;M的氧化物是导致酸雨的主要物质之一,所以M是氮元素或硫元素,依原子序数依次增大可确定M为氮元素;Y的基态原子核外有6个原子轨道处于半充满状态,所以Y为铬元素;Z能形成红色的和黑色的两种氧化物,Z为铜元素。
(1)铬离子的基态电子排布式可表示为:[Ar]3d3;
(2)NO3-的空间构型是平面三角形,H2O的价电子互斥模型名称为四面体型;
(3)Cu(H2O)42+的溶液中通入氨气,会形成Cu(NH3)42+,这是因为氧的电负性大于氮原子且半径相对较小,相对来说较难提供孤电子对以形成配位键,所以配体水分子被氨气分子替换;
(4)双键中含有1个π键,因此1molCO2中含有π键的数目为2NA;
(5)①AlP晶体的熔点高,则推测其为原子晶体;
②A点、B点的坐标分别为(0,0,0)和(1,1/2,1/2),由此可推知C点的坐标为(![]() );据均摊点分析可知该晶体每个晶胞中含有4个P原子,4个铝原子。据
);据均摊点分析可知该晶体每个晶胞中含有4个P原子,4个铝原子。据![]() g/cm3。
g/cm3。


 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案 一卷搞定系列答案
一卷搞定系列答案科目:高中化学 来源: 题型:
【题目】下列框图所示的物质转化关系中,甲是日常生活中常见的金属,乙、丙、丁是常见的气体单质。气体B 与气体C 相遇产生大量的白烟,D 是海水中浓度最高的盐(部分反应物和生成物及溶剂水已略去)。

请回答下列问题:
(1) B、E 的电子式为______________________、__________________。
(2)工业上常用电解饱和 D 溶液来制备丁,请写出此反应的化学方程式:_______;阴极产物为___________________________。
(3)A 和 E 加热条件下反应的化学方程式______________________________。
(4)乙和丙反应的化学方程式______________________________________。
(5)B 和氧气在催化剂作用能发生反应,写出其化学反应方程式:_____。
(6)固态的 A 和 C 晶体类型分别属于_________、__________;固态的 A 熔融时需要克服的微粒间作用力为___________,将C 溶于水需要克服的作用力为___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通常情况下,NCl3是一种油状液体,其分子空间构型与NH3相似,下列对NCl3和NH3的有关叙述正确的是( )
A. 分子中N—Cl键键长与CCl4分子中C—Cl键键长相等
B. NCl3分子是非极性分子
C. NBr3比NCl3易挥发
D. 在氨水中,大部分NH3与H2O以氢键(用“…”表示)结合形成NH3·H2O分子,则NH3·H2O的结构式为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在BaSO4饱和溶液中加入少量的BaCl2溶液产生BaSO4沉淀,若以Ksp表示BaSO4的溶度积常数,则平衡后溶液中
A.c(Ba2+)·c(SO42-)=Ksp,c(Ba2+)>c(SO42-)
B.c(Ba2+)=c(SO42-)=(Ksp)1/2
C.c(Ba2+)·c(SO42-)>Ksp,c(Ba2+)=c(SO42-)
D.c(Ba2+)·c(SO42-)≠Ksp,c(Ba2+)<c(SO42-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学兴趣小组设计如图所示的装置来验证元素非金属性的强弱:
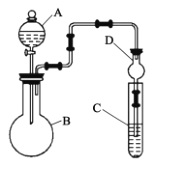
(1)仪器B的名称为___,干燥管D的作用是___。
(2)甲组同学的实验目的:证明非金属性:Cl>I。C中为淀粉—碘化钾混合溶液,B中装有KMnO4固体,则A中试剂为___,观察到C中溶液___(填现象),即可证明。但乙组同学认为该装置有明显的缺陷,改进方案是___。
(3)丙组同学的实验目的:证明非金属性:S>C>Si。在A中加稀硫酸、B中加Na2CO3溶液、C中加Na2SiO3溶液。观察到___(填现象),即可证明。C中发生反应的化学方程式为___。
(4)丁组同学的实验目的:证明非金属性:N>C>Si。实验方案与丙组同学的相似。在A中加稀硝酸、B中加Na2CO3溶液、C中加Na2SiO3溶液。观察到与丙组同学相同的实验现象,即可证明。但丙组同学认为该方案能证明非金属性:N>C,但不能证明非金属性:C>Si,理由是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于![]() 晶体网状结构(如图)的叙述正确的是
晶体网状结构(如图)的叙述正确的是
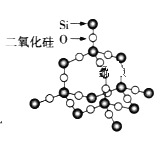
A. 存在四面体结构单元, ![]() 处于中心,
处于中心, ![]() 处于4个顶角
处于4个顶角
B. 最小环上有3个![]() 原子和3个
原子和3个![]() 原子
原子
C. 最小环上![]() 和
和![]() 原子数之比为1:2
原子数之比为1:2
D. 最小环上有6个![]() 原子和6个
原子和6个![]() 原子
原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于0.1mol·L-1 Na2CO3溶液的叙述错误的是( )
A.0.5 L该溶液中,Na+的物质的量浓度为0.2mol·L-1
B.1 L该溶液中,含CO32—的数目小于0.1NA(NA是阿伏加德罗常数)
C.从1 L该溶液中取出100 mL,则取出的溶液中Na2CO3的物质的量浓度为0.01mol·L-1
D.取该溶液10 mL,加水稀释至100 mL后,Na2CO3的物质的量浓度为0.01mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)写出SO3分子的空间构型是____;是____分子(填“极性”或“非极性”);常见的等电子体的化学式:一价阴离子______ (写出一种),它们的中心原子采用的杂化方式都是_______。
(2)甲醛(H2C=O)在Ni催化作用下加氢可得甲醇(CH3OH)。甲醇分子内C原子的杂化方式为__,甲醇分子内的O—C—H键角___(填“>”“<”或“=”)甲醛分子内的O—C—H键角,甲醇极易溶于水,其主要原因是_____。
(3)已知高碘酸有两种形式,化学式分别为H5IO6和HIO4,前者为五元酸,后者为一元酸。请比较二者酸性强弱:H5IO6_____(填“>”“<”或“=”)HIO4。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求完成下列填空
(1)检验铁离子(Fe3+):试剂____________(填化学式);现象______________。有铁离子(Fe3+)的环境下检验是否含有亚铁离子(Fe2+):试剂:_________(填化学式),现象_______________。
(2)用小苏打片治疗胃酸过多的离子方程式为____________。
(3)镁带着火时,不能用液态CO2灭火剂来灭火的原因是_____________。(用化学方程式表示).
(4)除去混入Fe2O3粉末中少量Al2O3杂质离子方程式为______________。
(5)将AlCl3溶液蒸干,灼烧,得到的固体产物是__________。AlCl3溶液和NaHCO3溶液混合时发生反应的离子方程式为_________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com