
| A、溶液中c(H+)和c(OH-)都减小 |
| B、溶液中c(H+)增大 |
| C、NH3?H2O电离平衡向左移动 |
| D、溶液pH增大 |


 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案科目:高中化学 来源: 题型:
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
| 2 | A | B | C | ||||
| 3 | D | E |
| 60℃ |
| 275℃ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、物质的摩尔质量等于其相对分子(原子)质量 |
| B、物质的量是一个基本的物理量,单位是摩尔 |
| C、0.12kg12C中所含的碳原子数为阿佛加德常数 |
| D、1mol任何物质中都含有阿佛加德常数个原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 光 |
| 或△ |
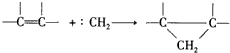
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、100mL容量瓶,7.2g |
| B、100mL容量瓶,8g |
| C、500mL容量瓶,8g |
| D、500mL容量瓶,7.2g |
查看答案和解析>>
科目:高中化学 来源: 题型:
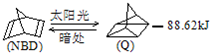 已知
已知  可简写为
可简写为 利用某些有机物之间的转化可贮存太阳能,如原降冰片二烯(NBD)经太阳光照转化成四环烷(Q)的反应为如图所示下列有关说法不正确的是( )
利用某些有机物之间的转化可贮存太阳能,如原降冰片二烯(NBD)经太阳光照转化成四环烷(Q)的反应为如图所示下列有关说法不正确的是( )| A、物质Q比NBD更稳定 |
| B、物质Q的一氯取代物只有3种 |
| C、一定条件下,1 mol NBD最多可与2 mol Br2发生加成反应 |
| D、NBD和Q二者互为同分异构体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com