
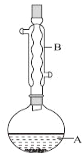
【题目】乙酸异戊酯是组成蜜蜂信息素的成分之一,具有香蕉的香味。实验室制备乙酸异戊酯的反应、装置示意图和有关数据如下:
相对分子质量 | 密度(g·cm-3) | 沸点/℃ | 水中溶解性 | |
异戊醇 | 88 | 0.812 3 | 131 | 微溶 |
乙酸 | 60 | 1.049 2 | 118 | 溶 |
乙酸异戊酯 | 130 | 0.867 0 | 142 | 难溶 |
实验步骤:
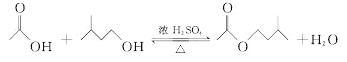
在A中加入4.4g异戊醇、6.0g乙酸、数滴浓硫酸和2~3片碎瓷片。开始缓慢加热A,回流50min。反应液冷至室温后倒入分液漏斗中,分别用少量水、饱和碳酸氢钠溶液和水洗涤;分出的产物加入少量无水![]() 固体,静置片刻,过滤除去
固体,静置片刻,过滤除去![]() 固体,进行蒸馏纯化,收集140~143℃馏分,得乙酸异戊酯3.9g。
固体,进行蒸馏纯化,收集140~143℃馏分,得乙酸异戊酯3.9g。
回答下列问题:
(1)仪器B的名称是_______________。
(2)在洗涤操作中,第一次水洗的主要目的是___________,第二次水洗的目的是______________。
(3)在洗涤、分液操作中,应充分振荡,然后静置,待分层后_____________(填标号)。
a.直接将乙酸异戊酯从分液漏斗的上口倒出
b.直接将乙酸异戊酯从分液漏斗的下口放出
c.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从下口放出
d.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从上口倒出
(4)本实验中加入过量乙酸的目的是。
(5)实验中加入少量无水![]() 的目的是_________________。
的目的是_________________。
(6)在蒸馏操作中,仪器选择及安装都正确的是__________(填标号)。
a. 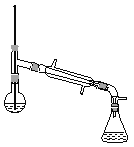 b.
b. 
c.  d.
d. 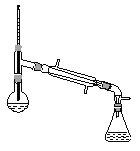
(7)本实验的产率是___________(填标号)。
a.30% b.40% c.60% d.90%
(8)在进行蒸馏操作时,若从130℃便开始收集馏分,会使实验的产率偏___________(填“高”或“低”),其原因是____________________。
【答案】球形冷凝管 洗掉大部分硫酸和醋酸 洗掉碳酸氢钠 d 提高醇的转化率 干燥 b c 高会收集少量未反应的异戊醇
【解析】
(1)根据题中仪器B的构造判断该仪器的名称;
(2)在洗涤操作中,第一次洗涤的主要目的是除去大部分催化剂硫酸和醋酸;第二次水洗,主要目的是除去产品中残留的碳酸氢钠;
(3)根据乙酸异戊酯的密度及正确的分液操作方法进行解答;
(4)根据反应中,增加一种反应物的浓度,可以使另一种反应物的转化率提高进行判断加入过量乙酸的目的;
(5)少量无水硫酸镁能够吸收乙酸异戊酯中少量的水分,起到干燥作用;
(6)先根据温度计在蒸馏操作中的作用排除ad,再根据球形冷凝管容易使产品滞留,不能全部收集到锥形瓶中,得出正确结论;
(7)先计算出乙酸和异戊醇的物质的量,然后判断过量情况,根据不足量计算出理论上生成乙酸异戊酯的物质的量,最后根据实际上制取的乙酸异戊酯计算出产率;
(8)若从130℃便开始收集馏分此时的蒸气中含有异戊醇,会收集少量的未反应的异戊醇,导致获得的乙酸异戊酯质量偏大。
(1)由装置中仪器B的构造可以知道,仪器B的名称为球形冷凝管;
(2)反应后的溶液要经过多次洗涤,在洗涤操作中,第一次洗涤的主要目的是除去大部分催化剂硫酸和醋酸;用饱和碳酸氢钠溶液既可以除去未洗净的醋酸,也可以降低酯的溶解度,所以第二次水洗,主要目的是除去产品中残留的碳酸氢钠;
(3)因为酯的密度比水小,二者互不相溶,因此水在下层,酯在上层;分液时,要先将水层从分液漏斗的下口放出,待到两层液体界面时关闭分液漏斗的活塞,再将乙酸异戊酯从上口放出,所以正确的为d;
(4)酯化反应是可逆反应,增大反应物的浓度可以使平衡正向移动,增加一种反应物的浓度,可以使另一种反应物的转化率提高;因此本实验中加入过量乙酸的目的是提高转化率;
(5)实验中加入少量无水硫酸镁的目的是吸收酯中少量的水分,对其进行干燥;
(6)在蒸馏操作中,温度计的水银球要放在蒸馏烧瓶的支管口处,所以ad错误;c中使用的是球形冷凝管容易使产品滞留,不能全部收集到锥形瓶中,因此仪器及装置安装正确的是b;故正确答案是b;
(7)乙酸的物质的量为![]() =0.1mol,异戊醇的物质的量为
=0.1mol,异戊醇的物质的量为![]() =0.05mol,因为乙酸和异戊醇是按照1:1进行反应,所以乙酸过量,生成乙酸异戊酯的量要按照异戊醇的物质的量计算,即理论上生成0.05mol乙酸异戊酯;实际上生成的乙酸异戊酯的物质的量为
=0.05mol,因为乙酸和异戊醇是按照1:1进行反应,所以乙酸过量,生成乙酸异戊酯的量要按照异戊醇的物质的量计算,即理论上生成0.05mol乙酸异戊酯;实际上生成的乙酸异戊酯的物质的量为![]() =0.03mol,所以实验中乙酸异戊酯的产率为:
=0.03mol,所以实验中乙酸异戊酯的产率为:![]() ×100%=60%,答案选c;
×100%=60%,答案选c;
(8)在进行蒸馏操作时,若从130℃便开始收集馏分此时的蒸气中含有异戊醇,会收集少量的未反应的异戊醇,因此会导致产率偏高。


 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:
【题目】重铬酸钠(Na2Cr2O72H2O)俗称红矾钠,在工业上有广泛的用途。我国目前主要是以铬铁矿(主要成份为FeOCr2O3,还含有Al2O3、MgO、SiO2等杂质)为主要原料进行生产,其主要工艺流程如下:
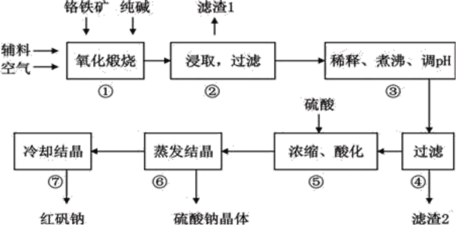
①中涉及的主要反应有:
主反应:4FeO·Cr2O3+8Na2CO3+7O2![]() 8Na2CrO4+2Fe2O3+8CO2
8Na2CrO4+2Fe2O3+8CO2
副反应:SiO2+Na2CO3![]() Na2SiO3+CO2↑、Al2O3+Na2CO3
Na2SiO3+CO2↑、Al2O3+Na2CO3![]() 2NaAlO2+CO2↑
2NaAlO2+CO2↑
部分阳离子以氢氧化物形式完全沉淀时溶液的pH:
沉淀物 | Al(OH)3 | Fe(OH)3 | Mg(OH)2 | Cr(OH)3 |
完全沉淀时溶液pH | 4.7 | 3.7 | 11.2 | 5.6 |
试回答下列问题:
(1)①中反应是在回转窑中进行,反应时需不断搅拌,其作用是__________________;
(2)③中调节pH至4.7,目的是__________________;
(3)⑤中加硫酸酸化的目的是使CrO42-转化为Cr2O72-,请写出该平衡转化的离子方程式:__________________;
(4)⑦中采用冷却结晶的方法析出红矾钠,依据是_________________________ ;
(5)制取红矾钠后的废水中还含有少量的CrO42-,根据有关标准,含CrO42-的废水要经化学处理,使其浓度降至5.0×10-7 mol·L-1以下才能排放。含CrO42-的废水处理通常有以下两种方法。
①沉淀法:加入可溶性钡盐生成BaCrO4沉淀[Ksp(BaCrO4)=1.2×10-10],再加入可溶性硫酸盐处理多余的Ba2+。加入可溶性钡盐后的废水中Ba2+的浓度应不小于__________________mol·L-1,后续废水处理方能达到排放标准。
②还原法:CrO42-![]() Cr3+
Cr3+![]() Cr(OH)3。绿矾还原CrO42-的离子方程式为:__________________。用该方法处理10 m3CrO42-的物质的量浓度为1.5×10-3 mol·L-1的废水,至少需要绿矾(FeSO47H2O,相对分子质量为278)的质量是__________________kg(保留两位小数)。
Cr(OH)3。绿矾还原CrO42-的离子方程式为:__________________。用该方法处理10 m3CrO42-的物质的量浓度为1.5×10-3 mol·L-1的废水,至少需要绿矾(FeSO47H2O,相对分子质量为278)的质量是__________________kg(保留两位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中华人民共和国国家标准(GB2760-2011)规定葡萄酒中SO2最大使用量为0.25 g·L-1。某兴趣小组用图1装置(夹持装置略)收集某葡萄酒中SO2,并对其含量进行测定。


(1)仪器A的名称是_________,水通入A的进口为_________。
(2)B中加入300.00 mL葡萄酒和适量盐酸,加热使SO2全部逸出并与C中H2O2完全反应,其化学方程式为______________________________________________________。
(3)除去C中过量的H2O2,然后用0.090 0 mol·L-1NaOH标准溶液进行滴定,滴定前排气泡时,应选择图2中的_________;若滴定终点时溶液的pH=8.8,则选择的指示剂为_________;若用50 mL滴定管进行实验,当滴定管中的液面在刻度“10”处,则管内液体的体积(填序号)_________(①=10 mL,②=40 mL,③<10 mL,④>40 mL)。
(4)滴定至终点时,消耗NaOH溶液25.00 mL,该葡萄酒中SO2含量为_________g·L-1。
(5)该测定结果比实际值偏高,分析原因并利用现有装置提出改进措施:__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A. 95℃时纯水的pH<7,说明加热可导致水呈酸性
B. pH=3的醋酸溶液,稀释至10倍时溶液的pH<4
C. 等浓度的醋酸溶液与氢氧化钠溶液等体积混合后pH=7
D. 等体积pH均为3的醋酸和盐酸分别与足量Zn反应,盐酸产生的H2多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】己烯雌酚是一种激素类药物,结构如 ![]() 下列叙述中正确的是
下列叙述中正确的是
A. 分子中有7个碳碳双键,可以与氢气1:7加成
B. 该分子中有2个H,2个O,6个C共直线
C. 该分子对称性好,所以没有顺反异构
D. 该有机物分子中,最多可能有18个碳原子共平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物W(C16H14O2)用作调香剂、高分子材料合成的中间体等,制备W的一种合成路线如下:
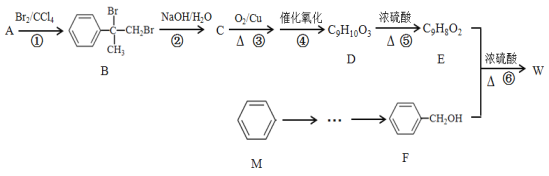
已知: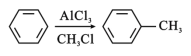
请回答下列问题:
(1)F的化学名称是_______,⑤的反应类型是_______。
(2)E中含有的官能团是_______(写名称),E在一定条件下聚合生成高分子化合物,该高分子化合物的结构简式为_______。
(3)E + F→W反应的化学方程式为_______。
(4)与A含有相同官能团且含有苯环的同分异构体还有_______种(不含立体异构),其中核磁共振氢谱为六组峰,且峰面积之比为1∶1∶2∶2∶2∶2的结构简式为____。
(5)参照有机物W的上述合成路线,写出以M和CH3Cl为原料制备F的合成路线(无机试剂任选)_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,0.1 mol·L-1某一元酸(HA)溶液中![]() =1×10-8,下列叙述正确的是
=1×10-8,下列叙述正确的是
A.溶液中水电离出的c(H+)=10-10 mol·L-1
B.溶液中c(H+)+c(A-)=0.1 mol·L-1
C.与0.05 mol·L-1 NaOH溶液等体积混合后所得溶液中离子浓度大小关系为:c(A-)>c(Na+)>c(OH-)>c(H+)
D.上述溶液中加入一定量CH3COONa晶体或加水稀释,溶液c(OH-)均增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用铂电极电解CuSO4和KNO3的混合液500mL,经过一段时间后,两极均得到标况下11.2L气体,则原混合液中CuSO4的物质的量浓度为
A.0.5mol·L-B.0.8mol·L-1
C.1.0mol·L-1D.1.5mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探索工业废料的再利用,某化学兴趣小组设计了如图1实验流程,用含有铝、铁和铜的合金废料制取氯化铝、绿矾晶体(FeSO47H2O)和胆矾晶体请回答:

(1)写出步骤Ⅰ反应的离子方程式: ______ 。
(2)试剂X是 ______。步骤Ⅰ、Ⅱ、Ⅲ中均需进行的实验操作是 ______。
(3)进行步骤Ⅱ时,该小组用如图2所示装置及试剂制取CO2并将制得的气体通入溶液A中.一段时间后,观察到烧杯中产生的白色沉淀会逐渐减少.为了避免固体C减少,可采取的改进措施是 ______。
(4)由溶液E到绿矾晶体(FeSO47H2O),所需操作是 ______ 、 ______ 、 ______ 、洗涤、干燥。
(5)用固体F制备CuSO4溶液,可设计如图3三种途径:写出途径①中反应的离子方程式 ______ ,请选出你认为的最佳途径并说明选择的理由 ______ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com