
【题目】常温下,0.1 mol·L-1某一元酸(HA)溶液中![]() =1×10-8,下列叙述正确的是
=1×10-8,下列叙述正确的是
A.溶液中水电离出的c(H+)=10-10 mol·L-1
B.溶液中c(H+)+c(A-)=0.1 mol·L-1
C.与0.05 mol·L-1 NaOH溶液等体积混合后所得溶液中离子浓度大小关系为:c(A-)>c(Na+)>c(OH-)>c(H+)
D.上述溶液中加入一定量CH3COONa晶体或加水稀释,溶液c(OH-)均增大
【答案】D
【解析】
溶液中![]() =1×10-8,由Kw=c(H+)×c(OH-)=10-14,可知c(H+)=10-3mol/L,
=1×10-8,由Kw=c(H+)×c(OH-)=10-14,可知c(H+)=10-3mol/L,
A.溶液中水电离出的c(H+)=c(OH-)=10-11mol/L,A错误;
B.HA为弱酸不能完全电离,由c(H+)=10-3mol/L可知c(H+)+c(A-)=0.002 mol/L,B错误;
C.与0.05mol/LNaOH溶液等体积混合后,HA过量,则溶液应呈酸性,应有c(H+)>c(OH-),C错误;
D.溶液中加入一定量CH3COONa晶体,发生:CH3COO-+H+CH3COOH,或加入水,都会导致c(H+)减小,c(OH-)增大,D正确;
故答案选D。


 中考解读考点精练系列答案
中考解读考点精练系列答案科目:高中化学 来源: 题型:
【题目】如图装置中,U形管内为红墨水,a、b试管内分别盛有食盐水和醋酸溶液,各加入生铁块,放置一段时间。下列有关描述不正确的是
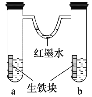
A.生铁块中的碳是原电池的正极
B.红墨水水柱两边的液面变为左低右高
C.两试管中相同的电极反应式是Fe-2e- = Fe2+
D.a试管中发生了吸氧腐蚀,b试管中发生了析氢腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组用下图装置制取并探究氯气的性质。[A装置中发生反应的化学方程式:2KMnO4+16HCl(浓)=2KCl+2MnCl2 + 5Cl2↑+ 8H2O ]

(实验探究)
(1)A装置中a仪器的名称是_____________。
(2)制取氯气反应中KMnO4所起的作用是_____(填“氧化剂”或“还原剂”)。
(3)实验进行一段时间后,可观察到______(填“B”或“C”)装置中有色布条褪色,其褪色原因是______________________________________。
(4)当氯气进入D装置后,可观察到溶液颜色变为____(填“红色”或“蓝色”),写出该反应的离子方程式为为_____________________________________。
(5)E装置中反应的化学方程式为_____________________________________。
(6)用31.6 g KMnO4固体与足量的浓盐酸反应,最多可生成标准状况下_____L氯气。(KMnO4的摩尔质量为158 g·mol—1)
(7)近年来,某些含氯的化合物(如ClO2、NaClO等)在生产、生活中应用广泛。
①高效净水剂ClO2中氯元素的化合价为_____________。
②NaClO是一种强氧化剂。某种家用洗涤剂含有NaClO,请写出NaCIO在洗涤过程中的一种作用___________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
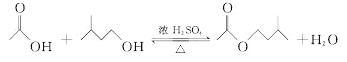
【题目】乙酸异戊酯是组成蜜蜂信息素的成分之一,具有香蕉的香味。实验室制备乙酸异戊酯的反应、装置示意图和有关数据如下:
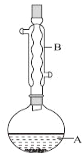
相对分子质量 | 密度(g·cm-3) | 沸点/℃ | 水中溶解性 | |
异戊醇 | 88 | 0.812 3 | 131 | 微溶 |
乙酸 | 60 | 1.049 2 | 118 | 溶 |
乙酸异戊酯 | 130 | 0.867 0 | 142 | 难溶 |
实验步骤:
在A中加入4.4g异戊醇、6.0g乙酸、数滴浓硫酸和2~3片碎瓷片。开始缓慢加热A,回流50min。反应液冷至室温后倒入分液漏斗中,分别用少量水、饱和碳酸氢钠溶液和水洗涤;分出的产物加入少量无水![]() 固体,静置片刻,过滤除去
固体,静置片刻,过滤除去![]() 固体,进行蒸馏纯化,收集140~143℃馏分,得乙酸异戊酯3.9g。
固体,进行蒸馏纯化,收集140~143℃馏分,得乙酸异戊酯3.9g。
回答下列问题:
(1)仪器B的名称是_______________。
(2)在洗涤操作中,第一次水洗的主要目的是___________,第二次水洗的目的是______________。
(3)在洗涤、分液操作中,应充分振荡,然后静置,待分层后_____________(填标号)。
a.直接将乙酸异戊酯从分液漏斗的上口倒出
b.直接将乙酸异戊酯从分液漏斗的下口放出
c.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从下口放出
d.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从上口倒出
(4)本实验中加入过量乙酸的目的是。
(5)实验中加入少量无水![]() 的目的是_________________。
的目的是_________________。
(6)在蒸馏操作中,仪器选择及安装都正确的是__________(填标号)。
a. 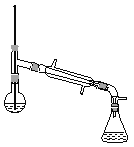 b.
b. 
c.  d.
d. 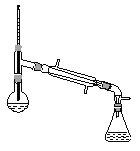
(7)本实验的产率是___________(填标号)。
a.30% b.40% c.60% d.90%
(8)在进行蒸馏操作时,若从130℃便开始收集馏分,会使实验的产率偏___________(填“高”或“低”),其原因是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将4 mol A气体和2 mol B气体在2 L的容器中混合并在一定条件下发生如下反应:2A(气)+B(气)![]() 2C(气)。若经2 s(秒)后测得C的浓度为0.6 mol·L-1,现有下列几种说法:
2C(气)。若经2 s(秒)后测得C的浓度为0.6 mol·L-1,现有下列几种说法:
①用物质A表示的反应平均速率为0.3 mol·L-1·s-1
②用物质B表示的反应的平均速率为0.6 mol·L-1·s-1
③2s时物质A的转化率为70%
④2s时物质B的浓度为0.7 mol·L-1
其中正确的是:
A.①③B.①④C.②③D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W为原子序数依次增大的短周期主族元素,Y、Z同周期且相邻,X、W同主族且与Y处于不同周期,Y、Z原子的电子数总和与X、W原子的电子数总和之比为5:4。化合物WYZ2是一种工业盐,对人体危害很大。下列叙述正确的是
A.简单氢化物的沸点:Y<Z
B.化合物WY3中只存在离子键
C.原子半径:W>Z>Y>X
D.X2Z与W2Z2发生的反应中,X2Z被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知充分燃烧a g乙炔气体时生成1 mol二氧化碳气体和液态水,并放出热量b kJ,则乙炔燃烧的热化学方程式正确的是
A. 2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l);△H=+b kJ/mol
B. C2H2(g)+![]() O2(g)=2CO2(g)+H2O(l);△H=+2b kJ/mol
O2(g)=2CO2(g)+H2O(l);△H=+2b kJ/mol
C. 2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l);△H=-2b kJ/mol
D. 2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l);△H=-4b kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图A为直流电源,B为浸透饱和氯化钠溶液和酚酞试液的滤纸,C为电镀槽,接通电路后,发现B上的c点显红色,请填空:
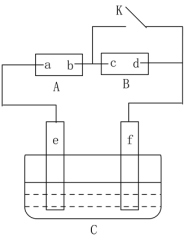
(1)电源A上的a为___极;
(2)滤纸B上发生的总化学方程式为:___;
(3)欲在电镀槽中实现铁上镀锌,接通K点,使c、d两点短路,则电极e上发生的反应为:___,电极f上发生的反应为:__,槽中盛放的镀液可以是___溶液。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】完成下列填空:
(1)在Fe(NO3)3溶液中加入Na2SO3溶液,溶液先由棕黄色变为浅绿色,过一会又变为棕黄色,溶液先变为浅绿色的原因是_________________(用文字表达),又变为棕黄色的离子方程式是_____________________。
(2)近几年开发的甲醇燃料电池采用铂作电极催化剂,电池中的质子交换膜只允许质子和水分子通过。其工作原理的示意图如下:

Pt(a)电极是电池的________极,电极反应式为________________________;Pt(b)电极发生________反应(填“氧化”或“还原”),电极反应式为_________________________
(3)已知铅蓄电池的工作原理为Pb+PbO2+2H2SO4![]() 2PbSO4+2H2O,现用如图装置进行电解(电解液足量),测得当铅蓄电池中转移0.4 mol电子时铁电极的质量减少11.2 g。请回答下列问题。
2PbSO4+2H2O,现用如图装置进行电解(电解液足量),测得当铅蓄电池中转移0.4 mol电子时铁电极的质量减少11.2 g。请回答下列问题。

①A是铅蓄电池的________极,铅蓄电池正极反应式为_____________________,
②Ag电极的电极反应式是__________________________,
③Cu电极的电极反应式是________________________________,
CuSO4溶液的浓度________(填“减小”“增大”或“不变”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com